CHAPITRE 5 : INTERACTIONS NON COVALENTES
Les « Avez-vous tout compris ? »¶
- Avez-vous tout compris ? - ¶
L’estragol est une espèce chimique présente dans les feuilles d’estragon. L’huile essentielle d’estragon aurait des vertus antiallergiques. Elle peut être extraite par hydrodistillation. Les phases aqueuse et organique de l’hydrodistillat obtenu sont très difficiles à séparer par une simple décantation. Une extraction liquide-liquide à l’aide d’un solvant est nécessaire. Parmi les solvants proposés dans le tableau ci-dessous, lequel choisit-on ?
| Cyclohexane | Dichlorométhane | Éthanol | |
|---|---|---|---|
| Densité | 0,78 | 1,33 | 0,79 |
| Pictogramme |

|

|

|
| Mention de danger | H225 - Liquide et vapeurs très inflammables.
H304 - Peut être mortel en cas d’ingestion et de pénétration dans les voies respiratoires.
H315 - Provoque une irritation cutanée.
H336 - Peut provoquer somnolence ou vertiges.
H410 - Très toxique pour les organismes aquatiques, entraîne des effets néfastes à long terme. | H335 - Peut provoquer somnolence ou vertiges.
H351 - Susceptible de provoquer le cancer. | H225 - Liquide et vapeurs très inflammables. |
- Avez-vous tout compris ? - ¶
Expliquer les différences de phases observées pour les dihalogènes , , et sous 1 bar et :
| Dihalogène | ||||
|---|---|---|---|---|
| État physique | Gaz | Gaz | Liquide | Solide |
- Avez-vous tout compris ? - ¶
Attribuer la température d’ébullition (, , ) à l’alcane correspondant (, , ).
- Avez-vous tout compris ? - ¶
Donner un classement des composés suivant leur température d’ébullition croissante.
- Avez-vous tout compris ? - ¶
Classer par ordre croissant de solubilité dans l’eau : l’acide formique (méthanoïque), le chlorométhane et le méthanal.
- Avez-vous tout compris ? - ¶
On appelle série éluotropique une série de solvants de pouvoirs éluants croissants. Justifier l’ordre des solvants dans la série éluotropique suivante : hexane < tétrachlorométhane < dichlorométhane < éther diéthylique < propanone < méthanol < eau.
- Avez-vous tout compris ? - ¶
On réalise la réaction de réduction de la vanilline.
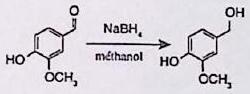
Pour caractériser le produit obtenu, on réalise la CCM suivante :
Éluant : mélange cyclohexane / éthanoate d’éthyle en proportion 50/50.
Phase fixe : silice.
Dépôts : A (Vanilline commerciale), B (Brut réactionnel), C (produit purifié).

Que contient le brut réactionnel ? Quelle serait l’allure du chromatogramme avec un éluant cyclohexane / éthanoate d’éthyle en proportion 30/70 ?
Exercices en autonomie¶
EXERCICE 1 : Identifier les interactions responsables de la cohésion (*)¶
Citer les interactions principales qui permettent la cohésion des composés suivants :
Hélium (gaz) :
Acétone (ou propanone) (liquide)
Eau solide (glace)
Solution de diiode dans le chloroforme ().
EXERCICE 2 : Températures de changement d’état (**)¶
En justifiant, classer par température d’ébullition croissante les composés suivants :
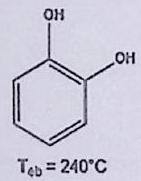
Butane
Propan-1-ol
1-chloropropane
Interpréter l’évolution des températures d’ébullition dans les séries suivantes.
(C)%5BSe%5D=%5BTe%5D%3C/smiles%3E%5D(https://cdn.mathpix.com/cropped/3a1a10f3-2442-417b-8d19-25f483176908-2.jpg?height=198&width=188&top_left_y=736&top_left_x=617))
EXERCICE 3 : Solubilité (**)¶
On indique ci-dessous les valeurs de la solubilité de plusieurs gaz dans l’eau à sous la pression atmosphérique.
| Gaz | |||
|---|---|---|---|
| () |
Comment peut-on interpréter l’évolution constatée ?
On indique ci-après les valeurs de la solubilité de deux gaz triatomiques dans l’eau sous la pression atmosphérique.
| Gaz | ||
|---|---|---|
| () |
2.1. Comment peut-on interpréter l’importante différence observée ? 2.2. Cette même solubilité est égale à dans le cas de l’ammoniac . Comment expliquer une valeur aussi importante de la solubilité comparée aux valeurs précédemment rencontrées dans l’exercice ?
Le chlorure de sodium est un solide ionique. 3.1. Expliquer la variation de solubilité de entre l’eau, le méthanol et l’éthanol. 3.2. L’acide 4-hydroxybenzoïque est plus soluble dans l’eau que l’acide salicylique (acide 2-hydroxybenzoïque). Expliquer.
Données : Solubilités à de dans l’eau : ; dans le méthanol ; dans l’éthanol .
EXERCICE 4 : Miscibilité de solvants (**)¶
Le cyclohexane est un solvant organique très utilisé au laboratoire.
Est-il miscible avec l’eau ? Avec l’éthanal ?
Discuter de la miscibilité relative du cyclohexane dans le méthanol et dans l’éthanol.
EXERCICE 5 : Extraction liquide-liquide (***)¶
On souhaite extraire le diiode contenu dans d’une solution aqueuse de diiode à par du cyclohexane. On notera le coefficient de partage, défini - pour rappel - comme étant la constante thermodynamique de l’équilibre :
Justifier le choix du cyclohexane.
Calculer la quantité de diiode extraite lors de l’extraction par un volume de cyclohexane. Discuter de l’influence sur l’efficacité de l’extraction du volume de solvant d’extraction choisi.
Calculer la quantité de diiode totale extraite lors de deux extractions successives, chacune par un volume de cyclohexane. Discuter de l’influence sur l’efficacité de l’extraction du nombre d’extractions par un volume de solvant donné.
EXERCICE 6 : Purification par recristallisation (***)¶
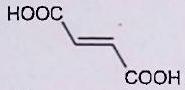
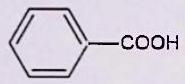
L’objectif de cet exercice est de purifier un échantillon solide d’acide fumarique par recristallisation dans l’eau. Le solide étudié contient essentiellement de l’acide fumarique et peut contenir de petites quantités d’acide maléique et d’acide benzoïque.
| dans l’eau pure | Acide maléique | Acide fumarique | Acide benzoïque |
|---|---|---|---|
| Structure |
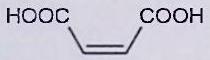
|
|
| | | 790 | 7,0 | 2,4 | | | 4000 | 100 | 75 |
Rappeler très brièvement la mise en œuvre classique de la recristallisation d’un solide dans un solvant. Les solubilités massiques dans l’eau de l’acide maléique, de l’acide fumarique et de l’acide benzoïque sont fournies ci-dessus. Ces solubilités seront considérées comme indépendantes de la présence d’autres espèces dissoutes. Elles sont égales à la quantité de matière de chacune des substances que l’on peut dissoudre par litre de solvant.
De quels paramètres dépend la solubilité d’une espèce chimique dans l’eau ? Peut-on prévoir quel est l’acide le plus soluble ?
On envisage la recristallisation dans l’eau d’un échantillon contenant d’acide fumarique et d’acide maléique. 3. Calculer le volume minimal nécessaire pour effectuer cette recristallisation en ayant intégralement dissous l’échantillon à . 4. Avec ce volume minimal d’eau , calculer la masse d’acide fumarique solide isolé après filtration à . Cet acide obtenu est-il pur ? 5. Quel inconvénient peut présenter l’utilisation d’un volume d’eau supérieur au volume minimal nécessaire ?
On envisage désormais la recristallisation dans l’eau d’un échantillon contenant de l’acide benzoïque et d’acide fumarique. 6. À quelle condition sur la masse d’acide benzoïque présente dans l’échantillon la recristallisation dans le même volume d’eau peut-elle donner de l’acide fumarique solide pur à .
EXERCICE 7 : Tensioactif SDS (***)¶
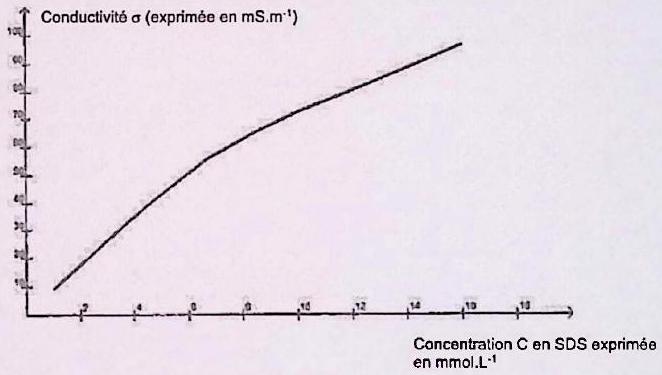
La majorité des détergents ou des cosmétiques utilisés au quotidien contiennent des tensioactifs. Le dodécylsulfate de sodium (SDS) est l’un des plus utilisés. Une solution de SDS de concentration molaire a été préparée à l’avance pour éviter la présence de mousse. On introduit dans un bécher d’eau distillée et on ajoute un volume de la solution de SDS. La conductivité de la solution obtenue est mesurée avec une sonde conductimétrique.
Les mesures sont consignées dans le tableau ci-dessous ( désigne la concentration molaire du SDS dans le mélange obtenu. La température est supposée constante pendant l’expérience) :
| () | 2.0 | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 50.0 |
|---|---|---|---|---|---|---|---|---|---|---|
| () | 1.0 | 4.71 | 6.67 | 8.42 | 10.0 | 11.4 | 12.7 | 13.9 | 16.0 | |
| () | 9.07 | 21.8 | 41.1 | 55.5 | 65.0 | 72.0 | 77.6 | 82.7 | 87.6 | 96.0 |
Donner une représentation de l’ion dodécylsulfate en précisant sa partie hydrophile et sa partie hydrophobe.
Représenter, sous forme d’un schéma, la manière dont les tensioactifs se placent à la surface de l’eau.
Expliquer l’allure de la courbe. En déduire la concentration micellaire critique (CMC) du SDS.
On verse de SDS dans d’eau distillée. La solution obtenue comporte-t-elle des micelles ?
Données :
Masse molaire du SDS :
Espèce tensioactive du SDS : ion dodécylsulfate
EXERCICE 8 : Autocatalyse micellaire lors d’une réaction de saponification (***)¶
L’hydrolyse basique de l’octanoate d’éthyle (un ester) par la soude, conduit à de l’octanoate de sodium et de l’éthanol. La transformation peut être modélisée par l’équation de réaction suivante :
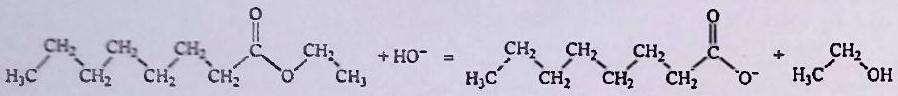
Un mélange initialement biphasique de d’octanoate d’éthyle et de de solution aqueuse de soude () de concentration est agité lentement à , de sorte que la frontière séparant les deux phases demeure visible. Après d’évolution, le mélange est monophasé. On enregistre au cours du temps les concentrations en octanoate de sodium et en micelles d’octanoate de sodium. On obtient la courbe suivante.
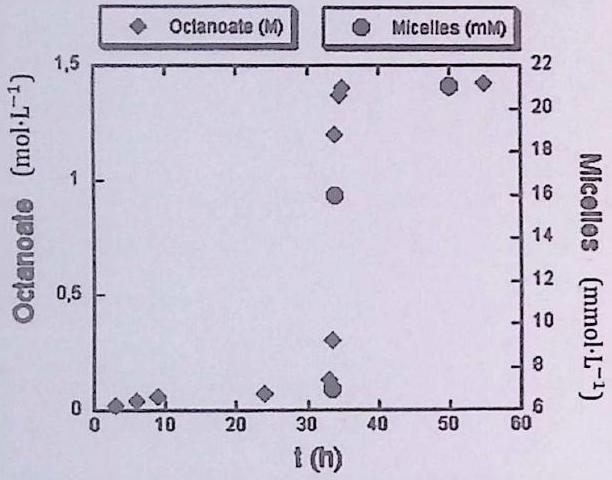
Référence : Chimie PCSI, Prépas sciences, Choubert/Finot, Ellipses
Pourquoi l’ion octanoate peut-il être qualifié d’amphiphile ?
Déterminer les quantités de matière initiales des réactifs. Quelle concentration en ions octanoate est attendue dans l’état final si la réaction est quantitative ?
Proposer une interprétation à l’allure de la courbe cinétique fournie. Déterminer la valeur de la concentration micellaire critique de l’ion octanoate.
Données concernant l’octanoate d’éthyle :¶
Masse molaire :
Densité :