1.3.2 Cas particulier des gaz
Ne pas confondre « molarité » avec la « molalité », qui est la quantité de soluté apportée à la masse de solvant (en ). En chimie des solutions aqueuses, vous pourrez parfois voir l’unité « » abrégée en « M », même si ce n’est pas recommandé...
Pour les solutions obtenues par dissolution (d’un solide de par exemple), on distingue :
| Concentration en soluté apporté | Concentration en soluté effective |
|---|---|
| calculée à partir des quantités de matière introduites | Calculée à partir des quantités de matière des espèces réellement en solution |
1.3.2 Cas particulier des gaz¶
Modèle du Gaz Parfait (GP) : Hypothèses du modèle des gaz parfaits :
molécules ponctuelles
pas d’interactions entre les molécules
Équation d’état du G.P. :
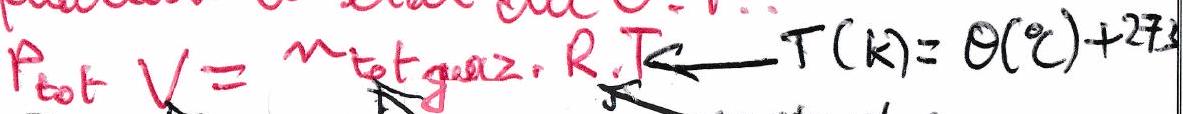
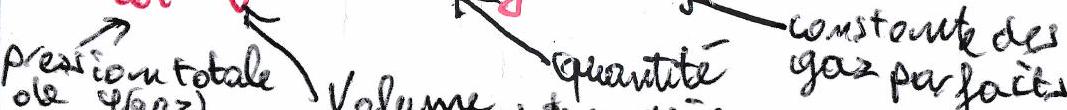
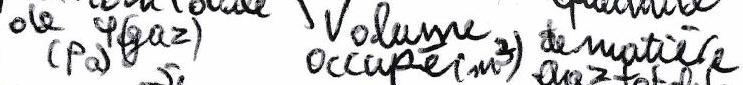
Dans un mélange gazeux :
Les gaz se mélangent toujours parfaitement : il n’y a qu’une seule phase gazeuse dans un système.
On note souvent la fraction molaire du constituant par
Pression partielle du gaz : pression qu’aurait le gaz s’il était seul dans le même volume et à la même température :
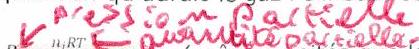
(mêmes unités que la loi des GP)
Paramètre intensif.

La pression totale est une grandeur mesurable par l’expérience. La pression partielle, elle, n’est pas directement mesurable.
La pression totale du mélange étant donnée par , on a :

1.4.2 Notion de phase¶
Définition : Une phase est une région de l’espace où les grandeurs intensives varient de manière continue en fonction des coordonnées de l’espace.
Système homogène : constitué d’une seule phase uniforme : les propriétés physiques (température, pression) ou chimiques (nature des molécules, composition chimique) sont les mêmes en tout point, ou ne varient que continûment.
Système hétérogène (ou polyphasé) : contient plusieurs phases (qui peuvent être dans le même état physique), soit un système avec une seule phase non uniforme.
Un constituant physico-chimique = constituant chimique (formule) + phase () ce qui doit figurer dans une réaction chimique
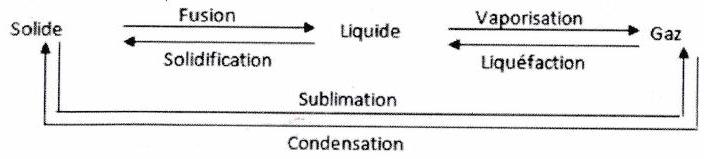
1.5 Les solutions¶
Définition : Une solution est un mélange homogène de plusieurs molécules, constituant une phase liquide ou solide, résultant de la dissolution d’un ou plusieurs soluté(s) (espèce chimique dissoute) dans un solvant (espèce chimique en grand excès).
Les molécules (ou les ions) de soluté sont alors solvatées et dispersées dans le solvant.
Souvent, la somme des fractions molaires des solutés est très inférieure à « solution diluée ».
Quand le rôle de solvant est rempli par l’eau (aqua en latin) solution aqueuse.
2 Transformation et réaction chimique¶
2.1 Transformation et équilibre¶
Définition : Un système est à l’équilibre thermodynamique quand ses paramètres physico-chimiques (, composition chimique) ne varient pas avec le temps.
Transformation : quand un système passe d’un état à un autre état d’équilibre final. Transformation chimique : transformation qui implique rupture ou formation de liaisons chimiques, ou échange électronique.
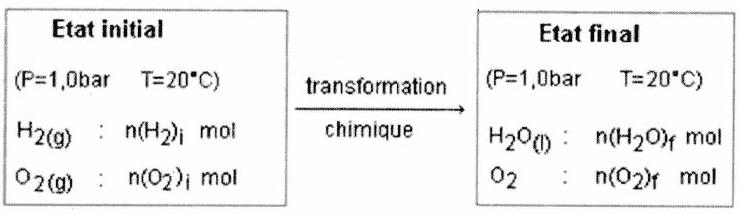
2.2 Modélisation de la transformation chimique : la réaction¶
Une transformation chimique est toujours complexe à appréhender. Il est en revanche possible de la modéliser par une réaction chimique. Toute réaction chimique est associée à une équation de réaction.
Exemple : le système {aluminium et acide chlorhydrique } subit une transformation chimique, que l’on peut modéliser par : modélisation macroscopique.
Équation de réaction associée à une réaction chimique :
Le coefficient placé devant chaque espèce chimique est appelé coefficient stœchiométrique. Ils sont choisis de façon à respecter :
la conservation des éléments chimiques (conservation de la matière).
la conservation de la charge électrique.
L’équation de réaction donne les proportions entre les différents ingrédients qui réagiront lors de la réaction, indépendamment de ce qu’on a introduit.
Par convention :
« réactifs » : constituants présents dans le membre de gauche de l’équation de réaction,
« produits » : constituants présents dans le membre de droite.

Réaction dans le sens direct : le réactif limitant est celui qui disparaît en 1er (donc pour le positif le plus proche de 0). donne la limite maximale . Rq : Si , (ça n’a aucun sens !!!)
Réaction dans le sens indirect : le produit qui joue le rôle de réactif limitant est celui qui disparaît pour le négatif le plus proche de 0. donne la limite minimale .
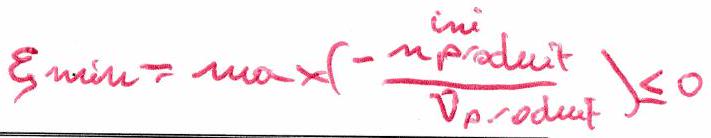
2.4 Conditions stœchiométriques¶
Les constituants et sont introduits en conditions stœchiométriques s’ils disparaissent au même avancement de la réaction.
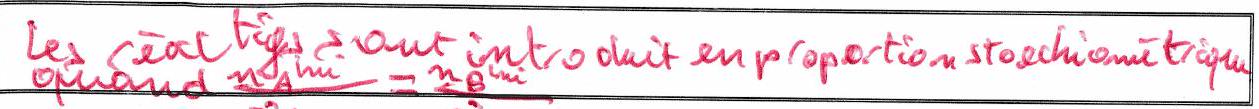

Ce n’est pas parce qu’un réactif est limitant qu’il disparaît forcément totalement : ce n’est vrai que si la réaction est totale, ce qui est finalement rare !
| Conséquence : si (en mol) | | = Produits | | :--- | :--- | :--- | | | | |
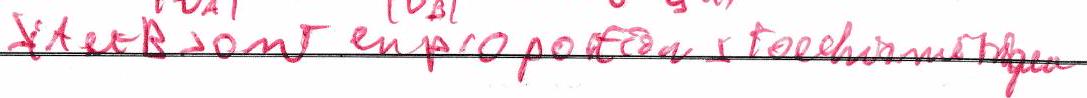
Avez-vous tout compris ? - ¶
Arguments d’entrée/sortie : ,
Objectif : Définir l’avancement volumique.
Consignes :
Utiliser l’avancement volumique (adapté pour travail à constant).
S’exprime en .
Construire le tableau d’avancement exactement de la même façon en remplaçant par .
Bien préciser l’unité retenue pour faire un tableau d’avancement.
2.5 État final¶

appartient à l’intervalle
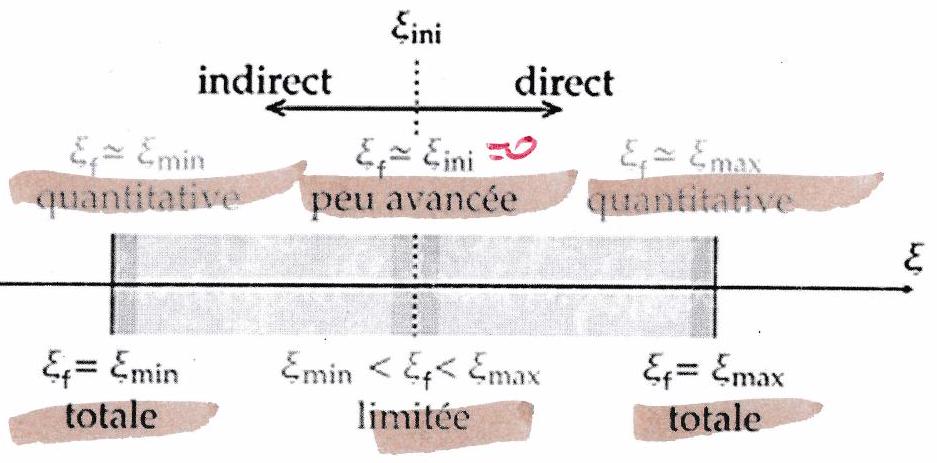
Quand on sait que l’état final est un équilibre (ex : travail en milieu homogène), on peut faire des approximations lors de la résolution de la LAM (équation ).
| Condition sur | ||
|---|---|---|
| Conséquence sur l’évolution | Réaction quantitative sens direct | Réaction quantitative sens indirect |
| État d’équilibre final | En faveur des produits. (Mais il reste toujours de tous les réactifs, y compris du limitant) | En faveur des réactifs (Mais il reste toujours de tous les produits, y compris du limitant). |
| Approx. possible pour simplifier la résolution |
On ne fait pas l’approx sur les termes du tableau d’avancement qui s’annulent avec l’approx : ce serait trop « violent » car on aurait « 0 » au numérateur (resp. au dénominateur) du alors que n’est jamais nulle (resp. infinie) !!
Si on fait une approximation, il faudra toujours vérifier si cette approx est cohérente avec les résultats obtenus.
En résumé : pour déterminer la valeur de (càd la composition de l’état final) :
On suppose que l’état final est un état d’équilibre pour pouvoir utiliser la LAM : la résolution de l’équation donne la valeur de .
On positionne trouvé par rapport à l’intervalle :
Si l’état final est un équilibre chimique.
Si (ou ) : (ou ) l’état final est un état hors équilibre (rupture d’équilibre)
Avez-vous tout compris ? - ¶
Avez-vous tout compris ? - ¶
5 Optimisation d’un système chimique¶
5.1 Déplacements d’équilibre¶
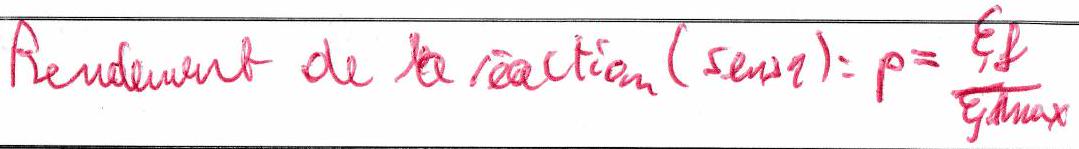
Optimiser une réaction consiste à augmenter le rendement, donc à déplacer la réaction dans le sens direct pour augmenter en jouant sur les paramètres à disposition de l’expérimentateur : , et les quantités de matière.
Principe :

5.2 Loi de modération¶
Le principe de Le Chatelier, ou loi générale de modération, déduit d’observations expérimentales, a été énoncé par Henry Le Chatelier en 1884 :
« Si des modifications extérieures légères apportées à un système physico-chimique en équilibre provoquent une évolution vers un nouvel état d’équilibre, alors cette évolution s’oppose aux perturbations qui l’ont engendrée et en modère l’effet. »
5.3 Influence de la température¶
On modifie .
Prédire l’évolution du système suite à la modification de la température :
Si est une fonction croissante, une augmentation de favorise la réaction dans le sens direct.
Si est une fonction décroissante, une augmentation de favorise la réaction dans le sens indirect.
| Si | ||
|---|---|---|
| Si (à fixée) : | Si (à fixée) : | |
| Le déplacement s’effectue dans le sens | Le déplacement s’effectue dans le sens | La pression totale n’est pas un facteur d’équilibre. |
| Consommation de gaz pour diminuer | Formation de gaz pour augmenter |
Exemple :
Approche quantitative de l’influence de la pression sur l’évolution On exprime en fonction de est proportionnel à (toute chose égale par ailleurs). On regarde comment évolue , donc on regarde le signe de .
Approche qualitative de l’influence de la pression sur l’évolution (Variante en phase gaz de la loi de Le Chatelier) : Une augmentation de pression totale provoque un déplacement de la réaction dans le sens de la diminution du .
Avez-vous tout compris ? - Avez-vous tout compris ? -
5.4 Influence de la composition¶
5.4.1 Influence de la pression TOTALE pour une réaction en phase gaz à T fixée¶
Si une réaction implique des espèces gazeuses, son quotient de réaction s’écrit :
Prédire l’évolution du système suite à la modification d’un paramètre de composition :
On raisonne sur une transformation donnée en regardant comment varie par rapport à suite à la perturbation :
On exprime en fonction, entre autres, du paramètre qui a varié ().
On regarde comment varie :
Si diminue évolution dans le sens direct.
Si augmente évolution dans le sens indirect.
5.4.2 Ajout d’un constituant en solution à T fixée¶
Avez-vous tout compris ? - ¶
5.4.3 Ajout d’un constituant inactif à et fixées ou à et fixés.¶
Avez-vous tout compris ? - ¶
6 Compétences exigibles¶
| Domaine | Compétences |
|---|---|
| Transformation chimique d’un système. Modélisation d’une transformation par une ou plusieurs réactions chimiques. Équation de réaction ; constante thermodynamique d’équilibre. | Écrire l’équation de la réaction (ou des réactions) qui modélise(nt) une transformation chimique donnée. Déterminer une constante thermodynamique d’équilibre et tester l’influence de différents paramètres sur l’état d’équilibre d’un système. Décrire qualitativement et quantitativement un système chimique dans l’état initial ou dans un état d’avancement quelconque. Exprimer l’activité d’une espèce chimique pure ou dans un mélange dans le cas de solutions aqueuses très diluées ou de mélanges de gaz parfaits avec référence à l’état standard. Exprimer le quotient de réaction. |
| Évolution d’un système lors d’une transformation chimique modélisée par une seule réaction chimique : avancement, activité, quotient de réaction, critère d’évolution. | Prévoir le sens de l’évolution spontanée d’un système chimique. Identifier un état d’équilibre chimique. Déterminer la composition chimique du système dans l’état final, en distinguant les cas d’équilibre chimique et de transformation totale, pour une transformation modélisée par une réaction chimique unique. |
| Composition chimique du système dans l’état final : état d’équilibre chimique, transformation totale. | Capacité numérique : déterminer, à l’aide d’un langage de programmation, l’état final d’un système, siège d’une transformation, modélisée par une ou deux réactions à partir des conditions initiales et valeur(s) de la(es) constante(s) thermodynamique(s) d’équilibre. |
| Optimisation d’un procédé chimique : - par modification de la valeur de ; - par modification de la valeur du quotient de réaction. | Identifier les paramètres d’influence d’un état d’équilibre et leur contrôle pour optimiser une synthèse ou minimiser la formation d’un produit secondaire indésirable. |
Table des matières¶
1 Le système physico-chimique ..... 1 1.1 Définitions ..... 1 1.2 Échelles d’un système ..... 1 1.3 Variables de descriptions ..... 1 1.4 États physiques et phases ..... 4 1.5 Les solutions ..... 5 2 Transformation et réaction chimique ..... 6 2.1 Transformation et équilibre ..... 6 2.2 Modélisation de la transformation chimique : la réaction ..... 6 2.3 Composition du système à tout instant ..... 7 2.4 Conditions stœchiométriques ..... 9 2.5 État final ..... 10 3 Activité d’un constituant ..... 12 3.1 Cas des gaz ..... 12 3.2 Cas des phases condensées (solides ou liquides) ..... 12 4 Évolution d’un système ..... 13 4.1 Quotient de réaction ..... 13 4.2 Constante d’équilibre ..... 13 4.3 Sens d’évolution d’un système chimique ..... 13 4.4 État final du système ..... 15 5 Optimisation d’un système chimique ..... 18 5.1 Déplacements d’équilibre ..... 18 5.2 Loi de modération ..... 19 5.3 Influence de la température ..... 19 5.4 Influence de la composition ..... 19 6 COMPÉTENCES EXIGIBLES ..... 22