Chapitre 1 : Structure de l’atome
1 Définitions¶
1.1 Atome¶
Un atome est un édifice électriquement neutre constitué :
d’un noyau avec protons (de charge ) et neutrons, soit nucléons charge totale du noyau :
et d’un nuage électronique avec électrons de charge évoluant autour du noyau charge totale du nuage électronique :
est le nombre de masse (ou nombre de nucléons).
Charge élémentaire (coulomb)
| Particule | Proton | Neutron | Électron |
|---|---|---|---|
| Masse | |||
| Charge | 0 |
Le noyau concentre presque toute la masse de l’atome :
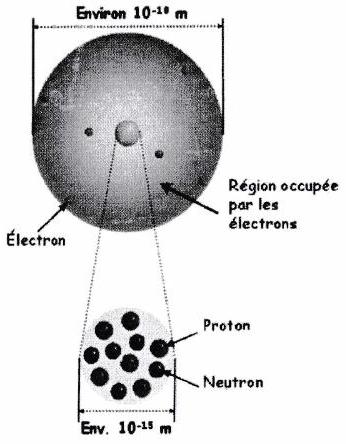
D’où le nom « nombre de masse » pour ... Un atome est essentiellement constitué de vide : structure lacunaire.
Les électrons et les noyaux sont des objets microscopiques : leur comportement est régi par les lois déroutantes de la mécanique quantique. L’analogie avec un système planétaire est très limitée !
1.2 Élément chimique¶
Élément chimique : Ensemble des atomes et des ions ayant le même numéro atomique . Notation : .
Ion : système atomique en excès ou en déficit d’électron(s).
1.3 Isotopes¶
Isotopes : Atomes (ou ions) de même numéro atomique mais nombre de nucléons différents (donc de différents).
Les isotopes d’un même élément sont représentés par le même symbole (car même ) et ne diffèrent que par leur nombre de neutrons.
Exception : L’hydrogène : grande variation relative de masse entre les trois isotopes naturels :
: Hydrogène
: Deutérium ()
: Tritium ()
Abondance isotopique : Pourcentage de cet isotope dans un échantillon de cet élément :
La masse naturelle d’un élément (atomique ou molaire) est la moyenne des masses (atomiques ou molaires) de ses nucléides connus, pondérées par leurs abondances naturelles. C’est celle qui est donnée dans le tableau périodique.
Avez-vous tout compris ? - ¶
Compétence vérifiée : Lier masse molaire naturelle et abondance isotopique.
1.4 Élément et transformation chimique¶
Lors d’une transformation chimique, les noyaux ne sont pas modifiés conservation des éléments chimiques. Aucun élément ne peut apparaître ou disparaître lors d’une transformation chimique.
2 Répartition des électrons¶
2.1 Les couches et sous-couches électroniques¶
Les électrons d’un atome se répartissent dans des couches électroniques numérotées Chaque couche est composée de sous-couches notées (puis ordre alphabétique).
La couche contient une seule sous-couche de type : elle est notée .
La couche contient 2 sous-couches de type et , notées et .
La couche contient 3 sous-couches de type et , notées et .
etc.
Chaque sous-couche () est divisée en cases quantiques appelées « orbitales atomiques » (OA).
Remarque (approfondie en 2ème année PC...) :¶
Une orbitale atomique (OA) est une fonction mathématique solution de l’équation de Schrödinger, qui décrit l’état d’un électron en physique quantique. Le nombre d’OA par sous-couche est lié à la définition de 3 nombres quantiques () qui caractérisent chaque OA : vous verrez ça en 2ème année.
Cette année, on retiendra : Nombre d’OA par sous-couche

| Sous-couche | ||||
|---|---|---|---|---|
| Nombre d’OA () | 1 | 3 | 5 | 7 |
| Représentation |
2.2 Configuration électronique dans l’état fondamental¶
2.2.1 Ordre de remplissage des sous-couches¶
La configuration électronique d’un atome dans son état fondamental correspond à la répartition des électrons dans les différentes OA qui conduit à l’état le plus stable possible. Les éléments chimiques ne sont constitués que d’atomes ayant le même nombre de protons. En revanche, les atomes sont les particules subatomiques (protons, neutrons et électrons) qui composent les éléments.
Règle empirique de Klechkowski (énoncé exact donné en 2ème année) : La répartition des électrons se fait dans un ordre précis qui correspond au niveau d’énergie croissant des sous-couches :

Au-delà de la , l’ordre de remplissage ne suit plus l’ordre des couches « croissant » :

On remplit complètement une sous-couche (avec le nombre maximal d’électrons qu’elle peut contenir) avant de passer à la sous-couche suivante pour placer les électrons restants.
2.2.2 Répartition des électrons dans une sous-couche¶
Règle de Hund : Les électrons se répartissent dans le maximum de « cases » avant de faire des paires.

Principe d’exclusion de Pauli : Chaque OA contient un nombre limité d’électrons : 2 au max (représenté par ).
Bilan : nombre d’électrons MAXIMAL par sous-couche :¶
| Sous-couche | ||||
|---|---|---|---|---|
| Nombre d’OA () | 1 | 3 | 5 | 7 |
| Illustrations |

|

|

| | Nbre max | 2 | 6 | 10 | 14 |
À ce stade de l’année, on retiendra que :
Plus un atome est volumineux, plus il est polarisable car ses électrons périphériques, plus éloignés du noyau, sont « moins retenus » en présence d’un champ électrique , il se déforme plus facilement.
Plus un atome est électronégatif, moins il est polarisable.
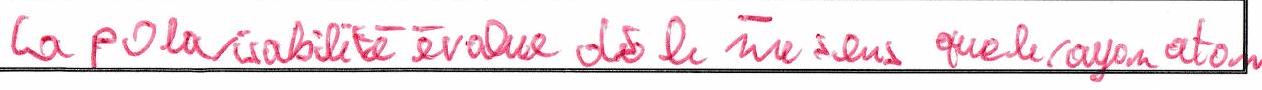
Avez-vous tout compris ? - ¶
Compétence vérifiée : Comparer les propriétés d’éléments à partir de leur position relative dans le TPE.
3.3 Les corps simples : métaux, non-métaux, métalloïdes¶
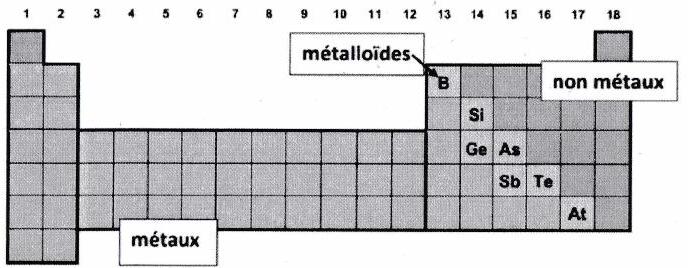

Les métaux :¶
Dans les conditions normales de et : solides (sauf le mercure), opaques et réfléchissants, de couleur grise (sauf l’or et le cuivre) ;
Malléables (facilement déformables) et ductiles (étirables en fils) ;
Bons conducteurs de l’électricité ;
Bons conducteurs thermiques ;
Bons réducteurs (sauf les métaux nobles) : perdent facilement un électron ;
Leurs oxydes sont basiques.
Métaux de transition : éléments chimiques dont les atomes ont une sous-couche électronique incomplète, ou qui peuvent former des cations dont la sous-couche électronique est incomplète.
Ce sont donc les éléments des groupes 3 à 11, y compris la plupart des lanthanides et des actinides. Les éléments de la colonne 12 ( : configuration ) en sont exclus car leur sous-couche est complète et ils forment des ions stables par départ des électrons .
Les non-métaux :¶
Dans les conditions normales de et : certains sont gazeux, d’autres solides (et 1 est liquide : le dibrome) ;
Couleurs variées ;
Ceux qui sont solides ne sont pas malléables (ils sont durs et/ou cassants) ;
Isolants électriques et thermiques ;
Leurs oxydes sont acides.
Les métalloïdes (ex : le silicium) :¶
Propriétés intermédiaires entre les métaux et les non-métaux :
Certaines propriétés des métaux (aspect brillant, couleur grise), certaines propriétés des non-métaux (cassants) ;
Certaines propriétés intermédiaires (conductivité électrique moyenne, oxydes amphotères...).
Certains métalloïdes comme le silicium sont des semi-conducteurs : leur conductivité électrique augmente quand la température augmente (alors que pour les métaux, elle baisse) ou bien par « dopage » du matériau avec des impuretés appropriées. Ces propriétés sont notamment utilisées dans le domaine de l’électronique.
Avez-vous tout compris ? - ¶
4 À l’issue de ce chapitre...¶
Capacités exigibles¶
À partir de la position de l’élément dans le TPE ou de la valeur du numéro atomique :
Déterminer, pour les éléments des blocs et , le nombre d’électrons de valence d’un atome.
Donner la configuration électronique d’un élément et d’un ion monoatomique (ex: ).
Comparer les propriétés (rayon atomique, électronégativité, polarisabilité) de deux atomes.
Citer les éléments des périodes 1 à 3 du tableau périodique (nom, symbole, numéro atomique).
Connaître les spécificités d’une ligne et d’une colonne du TPE.