Chapitre 7 : Réactivité en chimie organique
1. Transformation en chimie organique¶
1.1 Substrat et réactifs¶
En chimie organique de synthèse, l’objectif est de transformer une molécule organique appelée substrat en une autre, par le biais d’ajout d’autres réactifs.
Substrat : « qui subit l’action de... » (molécule d’intérêt : composé organique). Réactif : « qui réagit avec... » (peut être un composé minéral ou organique).
1.2 Écriture de réaction¶
Équation de la réaction (ou bilan) :¶
Bilan de matière lors de la réaction (d’où le signe « ») : elle est équilibrée (charges, atomes). Les solvants et catalyseurs n’apparaissent pas.
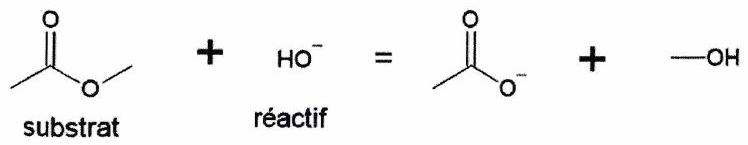
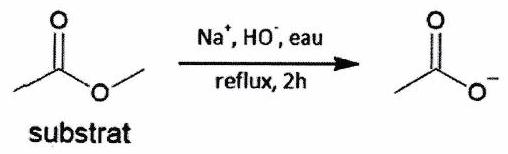
Schéma de synthèse :¶
Description « compacte » de la réaction, avec le substrat et les produits d’intérêt (pas forcément équilibrée). Le solvant, le catalyseur et les conditions opératoires (réactifs, , etc.) figurent sur une flèche simple. Décrire les conditions de transformation du substrat (pas le devenir des autres réactifs).
1.3 Mécanisme réactionnel (rappel)¶
Mécanisme réactionnel : Modélisation microscopique d’une réaction comme une suite d’actes élémentaires. On y respecte la chronologie des actes élémentaires.
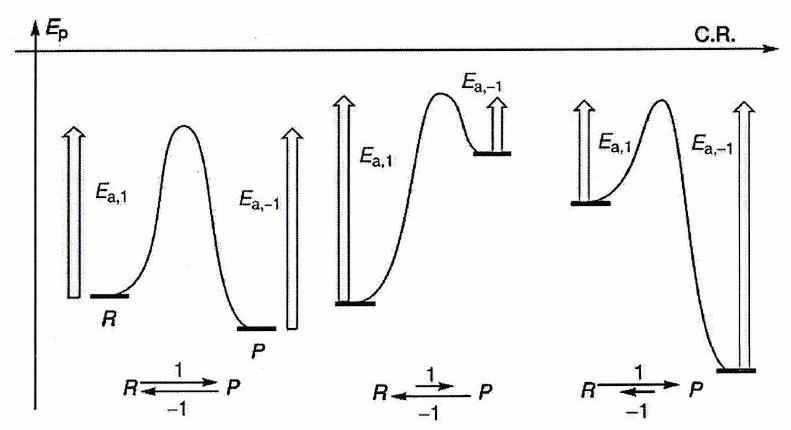
Profil d’énergie potentielle¶
[Contenu lié au profil d’énergie potentielle]
Formalisme des flèches courbes¶
Les déplacements d’électrons de chaque acte élémentaire sont représentés par des flèches.
Une demi-pointe (harpon) lorsqu’un seul électron se déplace.
Une pointe lorsqu’il s’agit d’un mouvement de doublet.
Comment bien écrire un mouvement d’électrons ?¶
Une flèche :
Doit partir d’un doublet d’électrons liant ou non-liant (site nucléophile).
Pointe vers un atome (site électrophile) (ou vers une liaison dans le cas de formation d’une liaison multiple).
Acte élémentaire¶
Sur un acte élémentaire (1 État de Transition étape), il y a peu de mouvements d’électrons :
Souvent 1 création de liaison et/ou 1 rupture de liaison.
Parfois 2 créations simultanées de liaisons (ou ruptures).
Jamais plus.
Principe de microréversibilité¶
Tous les actes élémentaires sont des processus réversibles : ils peuvent s’effectuer dans les deux sens. Flèche d’une étape : a priori double (microréversibilité d’un acte élémentaire).
Avez-vous tout compris ? - ¶
1.4 Intermédiaires réactionnels courants en chimie organique¶
| Nature | Carbocation (ou ion carbénium) | Carbanion |
|---|---|---|
| Définition | Une espèce chimique avec 1 atome porteur d’une charge | Une espèce chimique avec 1 atome porteur d’une charge |
| Struct. électronique | Lacune électronique sur le carbone | Doublet non-liant sur le carbone |
| Géométrie | Plan (trigonal) | Pyramide trigonale |
| Obtention | - Par rupture hétérolytique (le doublet liant reste lié à l’atome le plus électronégatif) d’une liaison covalente. - Par attaque électrophile d’un doublet de double liaison (doublet ). | - Sous l’action d’une base forte. - À partir d’organométalliques. |
1.5 Familles de transformation¶
| Type de réaction | Description | Schéma |
|---|---|---|
| Substitution (S) | Un groupe d’atomes a été remplacé par un autre dans le substrat. |

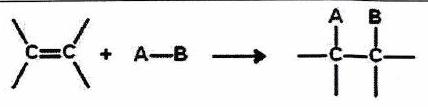
| | Addition (A) | Un groupe d’atomes se fixe sur une liaison multiple avec perte de cette liaison multiple. |
| | Élimination (E) | Un groupe d’atomes est parti du substrat en formant une liaison multiple. |
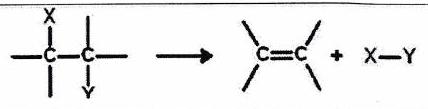
| | Acide-Base (A/B) | Transfert de proton (ou « prototropie » quand elle est intramoléculaire). | |
On ajoute en indice le type de réactif qui a permis la réaction sur le substrat :
: substitution nucléophile si le réactif est un nucléophile.
: addition nucléophile si le réactif est un nucléophile.
Avez-vous tout compris ? - ¶
| |
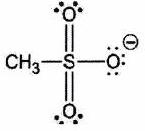
| (%5BO-%5D)=%5BSe%5D)cc1%3C/smiles%3E%5D(https://cdn.mathpix.com/cropped/60863430-5fb2-4964-837a-61ea98546b82-04.jpg?height=135&width=246&top_left_y=151&top_left_x=2291)) |
| :--- | :--- | :--- |
| Nom systématique | Ion méthylsulfonate | Ion paratoluènesulfonate |
| Nom usuel | Ion mésylate | Ion tosylate |
| Notation | | |
|
| :--- | :--- | :--- |
| Nom systématique | Ion méthylsulfonate | Ion paratoluènesulfonate |
| Nom usuel | Ion mésylate | Ion tosylate |
| Notation | | |
Bilan :¶

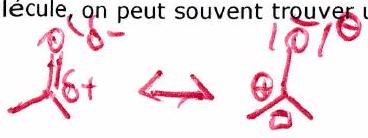
Avez-vous tout compris ? - ¶
2.2 Nucléofugacité (propriété d’un groupe partant)¶
Groupe partant (ou nucléofuge) : Groupe d’atomes qui peut facilement quitter l’atome auquel il est attaché en emportant les électrons de la liaison.
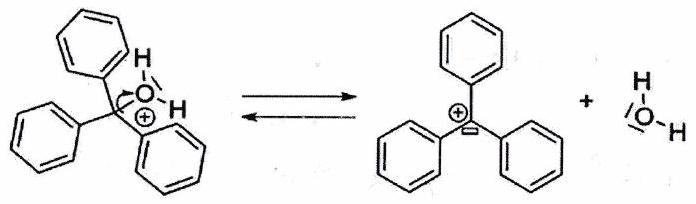
Reconnaître un bon nucléofuge :¶
On constate expérimentalement qu’un groupement partant sera d’autant meilleur :
Qu’il est polarisable.
Qu’il s’agit d’une base faible (neutre ou anion stabilisé par mésomérie).

3. Effets électroniques - conséquences sur la réactivité¶
Groupe d’atomes attracteur : Attire vers lui les électrons. Groupe d’atomes donneur : Apporte des électrons aux atomes voisins.
3.1 Les différents types d’effets électroniques¶
Effet inductif ( ou )¶
L’effet inductif est dû aux différences d’électronégativités des atomes dans une liaison. Si le groupe d’atomes contient un atome très électronégatif () : il est inductif attracteur (noté ).
L’effet inductif s’atténue très rapidement avec la distance.
Les effets inductifs sont cumulatifs.
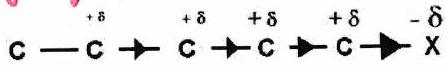
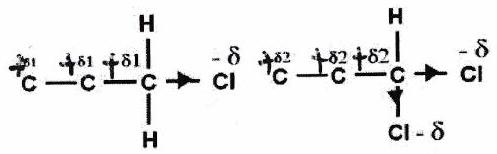
Effet mésomère ( ou )¶
On rappelle qu’il y a délocalisation possible d’électrons (conjugaison) lorsqu’il y a existence d’une alternance.
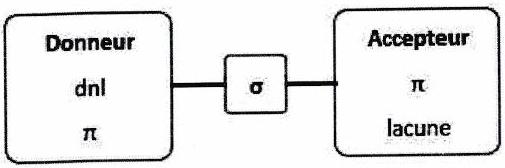
Méthode : Pour vérifier si un groupe a un effet mésomère, on l’imagine lié à un voisin :
S’il peut recevoir un doublet d’électrons par mésomérie : il est mésomère attracteur (effet ).
S’il peut donner un doublet d’électrons par mésomérie : il est mésomère donneur (effet ).

Coexistence des effets mésomères et effets inductifs :¶
| Effets | Type de groupe |
|---|---|
| / | Attracteur (ex: groupes carbonyles, nitro) |
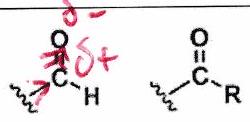
| | / | Donneur (si ) ou Attracteur (si , cas des halogènes) | | / | Donneur |


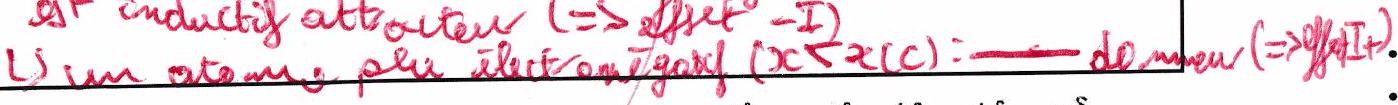
Règles de priorité :
Quand les deux effets sont de même signe : ils s’ajoutent. Ex : : groupe attracteur.
Quand les deux effets sont opposés : L’effet mésomère est généralement prépondérant sur l’effet inductif (ex : groupe sera donneur). SAUF pour les halogènes (, ) : l’effet inductif l’emporte.
Effet inductif () des alcènes (resp. alcynes) : lié à l’électronégativité « corrigée » du carbone (resp. ) plus élevée que celle du carbone .
L’effet mésomère peut se propager par conjugaison.
4. Sélectivité¶
4.1 Sélectivité et spécificité¶
Réaction sélective : Réaction au cours de laquelle un chemin réactionnel est privilégié parmi plusieurs possibles elle conduit préférentiellement à un produit parmi plusieurs possibles.
Réaction spécifique : Réaction dont le produit obtenu dépend de la stéréochimie du réactif.
4.1.1 Chimiosélectivité¶
Réaction chimiosélective : Réaction au cours de laquelle un réactif peut réagir avec plusieurs groupes fonctionnels au sein d’une molécule, mais réagit préférentiellement avec l’un d’eux.
Exemple :
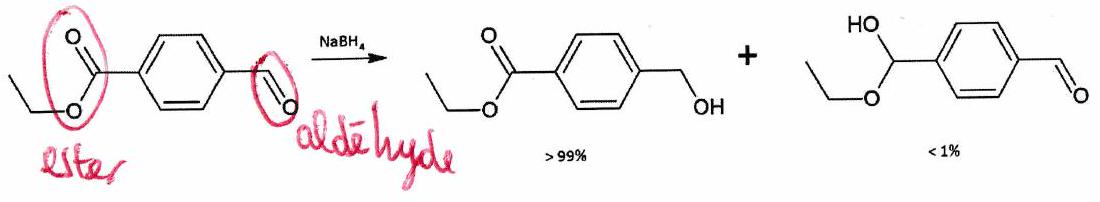
4.1.2 Régiosélectivité¶
Réaction régiosélective : Réaction conduisant à la formation préférentielle de certains isomères de position (régioisomères) parmi tous ceux pouvant être a priori obtenus.
Exemple :
4.1.3 Stéréosélectivité¶
Réaction stéréosélective : Réaction conduisant à la formation préférentielle de certains stéréoisomères de configuration, parmi tous ceux pouvant être a priori obtenus.
On distingue :
Diastéréosélectivité : la réaction produit préférentiellement un diastéréoisomère plutôt qu’un autre.
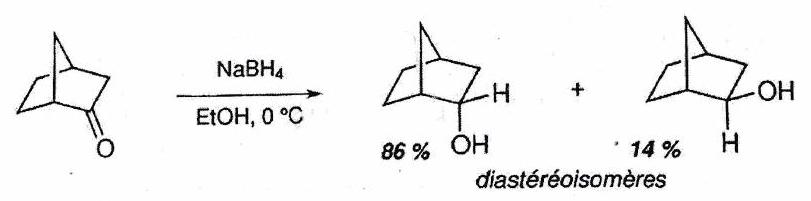
Énantiosélectivité : la réaction produit préférentiellement un énantiomère plutôt qu’un autre.
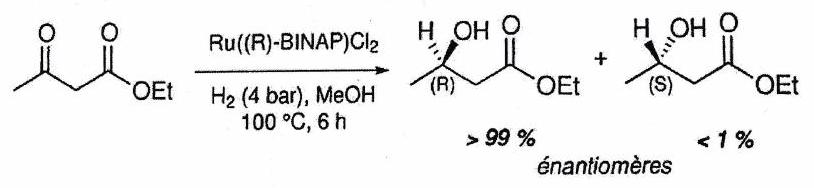
Stéréospécificité :¶
Si la configuration stéréochimique du produit majoritaire dépend de celle des réactifs, la transformation est stéréospécifique. Une réaction stéréospécifique est nécessairement stéréosélective (mais l’inverse n’est pas vrai).
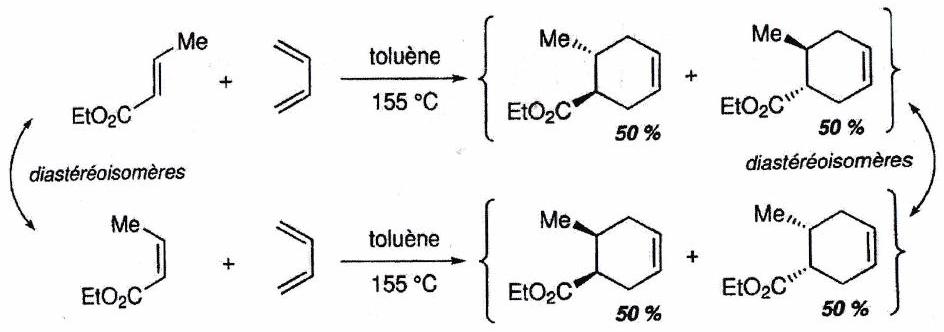
Avez-vous tout compris ? - ¶
Avez-vous tout compris ? - ¶
4.2 Contrôle cinétique, contrôle thermodynamique¶
Lorsqu’il est possible d’obtenir plusieurs produits de réaction à l’issue de deux chemins réactionnels :
Identifier le produit majoritaire sous contrôle thermodynamique :¶
C’est-à-dire le produit le plus stable. Pour comparer la stabilité de différents produits, on peut étudier :
L’existence d’une conjugaison (voire d’une aromaticité).
L’existence d’une liaison hydrogène intramoléculaire,
L’existence de répulsions déstabilisantes (tension de cycle pour des cycles de petite taille, encombrement, etc...)
Identifier le produit majoritaire sous contrôle cinétique :¶
Càd le produit qui se forme le plus vite. Identifier l’étape la plus lente du processus (celle d’énergie d’activation la plus grande). Identifier le produit issu de l’étape qui se forme le plus vite grâce au postulat de Hammond.
4.3 Postulat de Hammond(-Leffler)¶
Pour un acte élémentaire, dans le cadre d’un contrôle cinétique, le produit obtenu sélectivement correspond à la voie où l’état de transition est le plus stable (alors il est plus facile de franchir la barrière énergétique et le produit est formé plus rapidement). il faut examiner la stabilité de l’état de transition, dont on ne connaît pas la structure ???
Postulat de Hammond : « Si deux états consécutifs au cours d’un processus réactionnel possèdent des énergies proches, alors leur interconversion se fait avec une faible réorganisation de structure ».
| État de transition | Précoce | Tardif (cas le plus fréquent vers un IR) |
|---|---|---|
| Profil réactionnel |
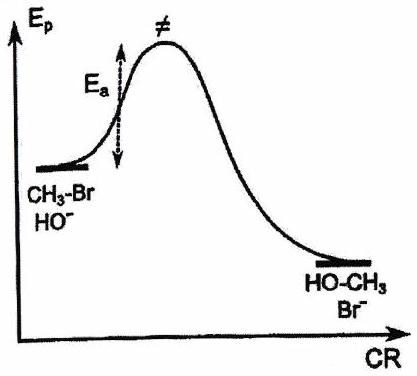
|
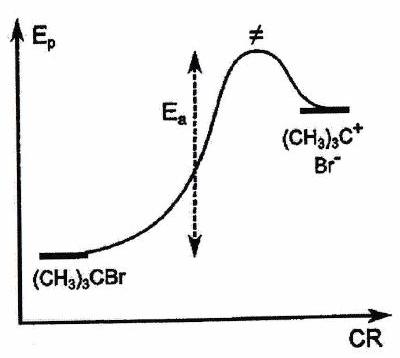
| | Structure du complexe activé | Proche de la structure des réactifs
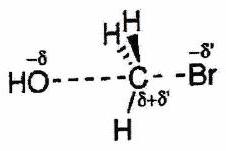
| Proche de la structure des produits ou IR
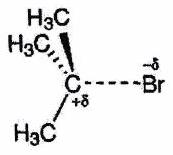
|
Avez-vous tout compris ? - ¶
Sous contrôle cinétique, le produit obtenu majoritairement sera donc celui correspondant à l’IR issu de l’étape lente le plus stable.
Exemple d’une réaction de substitution nucléophile
Première étape
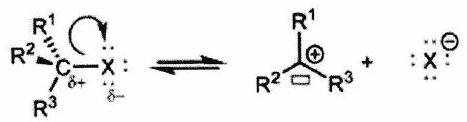
Seconde étape

Lakanal - PCSI
5 Réactions acide-base en chimie organique¶
5.1 Différentes définitions de l’acidité¶
5.1.1 Acido-basicité selon Brønsted-Lowry¶
Acide de Brønsted (ou ) : espèce moléculaire ou ionique susceptible de donner un proton Base de Brønsted (ou ) : espèce moléculaire ou ionique susceptible de capter un proton.
Un acide et sa base conjuguée forment un couple acide-base caractérisé par la constante thermodynamique de la réaction de dissociation : (ou )
Concept thermodynamique : les acides de Brønsted se comparent avec des constantes d’équilibre thermodynamiques.
Pour identifier les H acides (selon Brønsted) d’une molécule :¶
Repérer :
les car liés à un atome plus électronégatif (O, N, C si lié à un groupe avec effet inductif (), ...)
les H dont le départ conduit à une base conjuguée stabilisée (notamment par mésomérie).
Avez-vous tout compris ? - ¶
Avez-vous tout compris ? - ¶
5.1.2 Acido-basicité selon Lewis¶
Contrairement à l’acido-basicité de Brønsted qui ne s’intéresse qu’à l’échange d’un électrophile (le proton), l’acidobasicité au sens de Lewis prend en compte tous les électrophiles et nucléophiles :
Acide de Lewis : espèce capable d’accepter un doublet électronique libre (donc possédant une lacune électronique). Base de Lewis : espèce capable de donner un doublet électronique (donc possédant un ou plusieurs doublets électroniques non-liants).
, associée à une constante thermodynamique Concept thermodynamique : les acides de Lewis se comparent avec des constantes d’équilibre thermodynamiques.
| Exemples d’acides selon Lewis | Exemples de bases selon Lewis |
|---|---|
| Cations : Molécules neutres : | Anions : Molécules neutres : |
Remarques :¶
Certains acides de Lewis sont des acides de Brønsted.
Presque toutes les bases de Lewis sont des bases de Brønsted.
Acidobasicité selon Lewis et Électrophilie/nucléophilie sont 2 notions proches mais non équivalentes :
L’acidobasicité de Lewis est un concept thermodynamique.
L’électrophilie/nucléophilie est un concept cinétique.
Un acide de Lewis (composé avec lacune) est un électrophile mais l’inverse n’est pas systématiquement vrai. Une base de Lewis (composé avec dnl) est un nucléophile mais l’inverse n’est pas systématiquement vrai.
5.2 Acides et bases de Brønsted en Chimie Organique¶
5.2.1 Force d’un acide/d’une base¶
La constante acido-basique (ou constante d’acidité) du couple est la constante thermodynamique de l’équation chimique de dissociation de l’acide dans l’eau :
On définit
En milieu non aqueux, on utilise les généralisés donnant les valeurs des extrapolées à ce qu’elles auraient été dans l’eau (l’emploi de solvants non aqueux permet d’utiliser des espèces non stables dans l’eau car trop acides ou basiques).
| Son est... | ...forme facilement*... | ||
|---|---|---|---|
| Un acide fort... | ...cède facilement* un | Faible | ... sa base conjuguée |
| Une base forte... | ... capte facilement* un | élevé | ... son acide conjugué |
est grand plus l’acide est déprotoné à l’état d’équilibre final plus la base conjuguée est stable (concept thermo)
Comparer la force de deux acides¶
On compare la stabilité relative de leur base conjuguée.
Avez-vous tout compris ? - ¶
Avez-vous tout compris ? - ¶
Avez-vous tout compris ? - ¶
ACIDES
6 Connaissances et compétences exigibles¶
| Connaissances | Compétences |
|---|---|
| Conséquences de la structure sur la réactivité : nucléophile, électrophile. | Identifier les sites électrophiles et/ou nucléophiles d’une entité chimique. |
| Modélisation microscopique d’une transformation : mécanisme réactionnel, acte élémentaire, molécularité, complexe activé, intermédiaire réactionnel. | Distinguer l’équation chimique symbolisant une réaction chimique de l’équation traduisant un acte élémentaire. Distinguer un intermédiaire réactionnel d’un complexe activé. Tracer et commenter un profil énergétique correspondant à un acte élémentaire ou à plusieurs actes élémentaires successifs. |
| Contrôle cinétique, contrôle thermodynamique. | Reconnaître les paramètres qui favorisent la formation d’un produit dans le cas de deux réactions compétitives. |
| Formalisme des flèches courbes. | Utiliser le formalisme des flèches courbes pour rendre compte d’un acte élémentaire et le relier aux caractères nucléophile et électrophile des entités. |
Table des matières¶
1 Transformation en chimie organique ..... 1 1.1 Substrat et réactifs ..... 1 1.2 Ecriture de réaction ..... 1 1.3 Mécanisme réactionnel (rappel). ..... 2 1.4 Intermédiaires réactionnels courants en chimie organique ..... 3 1.5 Familles de transformation ..... 4 2 Reactivite des molecules ..... 5 2.1 Nucléophilie et électrophilie ..... 5 2.2 Nucléofugacité (Groupe partant) ..... 7 3 Effets ELECTRONIQUES - CONSEQUENCES SUR LA REACTIVITE ..... 9 3.1 Les différents types d’effets électroniques... 9 3.2 Effets électroniques et réactivité ..... 11 3.3 Effets stériques ..... 12 4 Selectivite ..... 13 4.1 Sélectivité et spécificité. ..... 13 4.1.1 Chimiosélectivité ..... 13 4.1.2 Régiosélectivité ..... 13 4.1.3 Stéréosélectivité ..... 13 4.2 Contrôle cinétique, contrôle thermodynamique. ..... 14 4.3 Postulat de Hammond(-Leffler) ..... 17 5 Reactions acide-base en chimie organique. ..... 19 5.1 Différentes définitions de l’acidité ..... 19 5.1.1 Acido-basicité selon Brønsted-Lowry ..... 19 5.1.2 Acido-basicité selon Lewis ..... 19 5.2 Acides et bases de Bronsted en Chimie Organique. ..... 20 5.2.1 Force d’un acide/d’une base ..... 20 5.2.2 Echelle de en Chimie Organique ..... 21 6 CONNAISSANCES ET COMPETENCES EXIGIBLES ..... 23 7 TD : Les « Avez-vous tout compris ? » ..... 25