Chap. 8 - Modification fonctionnelle : Substitution nucléophile et \beta-élimination
1 Les halogénoalcanes¶
1.1 Définition¶
Composé résultant du remplacement d’un atome d’hydrogène par un ou plusieurs atomes d’halogène principalement (ceux avec sont très peu réactifs : peu utilisés).
Formule générale d’un dérivé saturé monohalogéné : avec .
Nom : halogénoalcane (ou halogénure d’alkyle). On étend ensuite la définition aux composés carbonés halogénés (saturés ou non, avec un ou plusieurs ).
Au programme : Dérivés monohalogénés dans lesquels l’halogène est lié à un atome tétraédrique carbone potentiellement asymétrique.
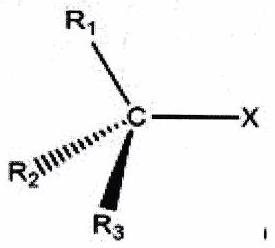
1.2 Classes¶
| Dérivé | Description | Structure |
|---|---|---|
| Dérivé primaire | Un seul groupe alkyle lié à |
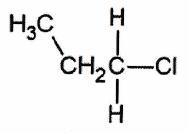
| | Dérivé secondaire | 2 groupes alkyles liés à |
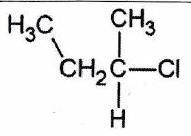
2-chlorobutane |
| Dérivé tertiaire | 3 groupes alkyles liés à |
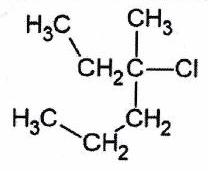
3-chloro-3-méthylhexane |
1.3 Propriétés physiques¶
Liquides dans les conditions normales de et de (seuls sont gazeux).
Insolubles dans l’eau.
Bons solvants pour de nombreux composés organiques : Solvants aprotiques, apolaires (ex : ) ou moyennement polaires ().
1.4 Réactivité¶
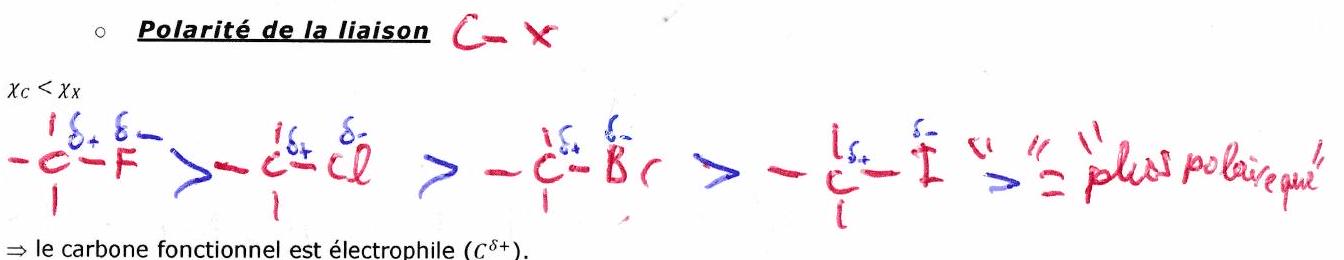
Polarisabilité de la liaison
La réactivité comparée des halogénoalcanes est principalement liée à la polarisabilité. Taille ou volume de : . Plus la liaison est polarisable, plus elle est longue, plus le est nucléofuge.

Groupe partant ou nucléofuge : Entité chimique qui se détache d’une molécule en emportant un doublet non liant lors de la rupture de la liaison.
Volume de l’atome : . La réactivité des évolue selon : (très peu réactif). (Lié à la polarisabilité de ) donc au caractère nucléofuge de .

*Si le carbocation est stabilisé par mésomérie, même si C est peu encombré, la est favorisée.
Avez-vous tout compris ? ¶
Avez-vous tout compris ? ¶
Avez-vous tout compris ? ¶
2 Substitution nucléophile ()¶
(Contenu des sections 2.1 à 2.4 non présent dans la source)
2.5 Transposition (ou réarrangement) de Wagner-Meerwein (HP)¶
Observation expérimentale :

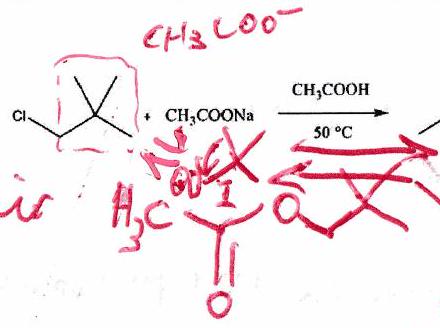


(Par déplacement d’un groupe alkyle)
Lorsqu’une réaction se produit avec un mécanisme permettant la formation d’un carbocation, des isomérisations (changement de position d’un groupement) peuvent se produire : Réactions de transposition.

Les réactions de transposition sont en général difficiles à prévoir et dépendent beaucoup des conditions opératoires. Ne penser aux transpositions que si le résultat final proposé ne correspond pas à ce qui était attendu.
3 Réactions de -élimination E2¶
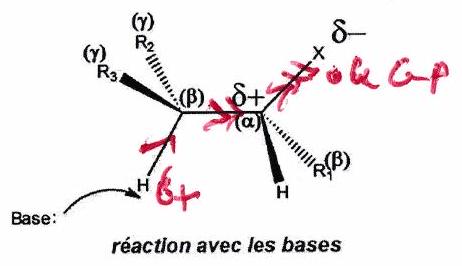
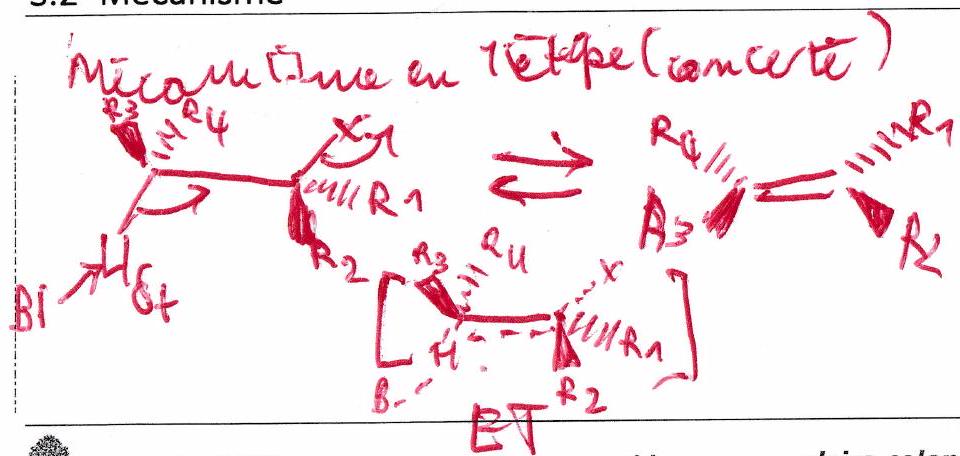
-élimination : réaction où l’on observe le départ de 2 atomes (ou groupes d’atomes) situés sur 2 carbones adjacents, ce départ conduisant à la création d’une double liaison carbone-carbone.
Trois mécanismes limites sont admis : le mécanisme , le mécanisme et le mécanisme . Nous n’envisageons que le mécanisme dans ce chapitre car tous les dérivés monohalogénés réagissent essentiellement suivant ce mécanisme. (On verra le mécanisme au second semestre et le sera vu en année).
3.1 Bilan général¶
Observations expérimentales :
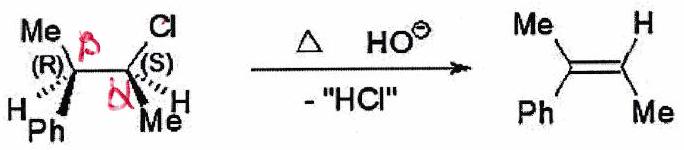
La réaction est d’ordre global 2 :
Pour pouvoir subir une -élimination, une molécule doit posséder :
Un groupe électroattracteur porté par un tétraédrique : ici un halogène .
Un groupe électrodonneur sur l’un des en : ici un .
L’effet inductif attracteur de se transmet de liaison en liaison (en s’atténuant) les atomes liés au(x) atome(s) en position de l’halogène sont donc acides : ils pourront être arrachés sous l’action d’une base forte.
La réaction est stéréospécifique.


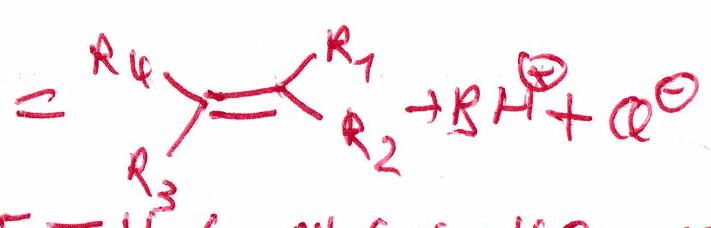
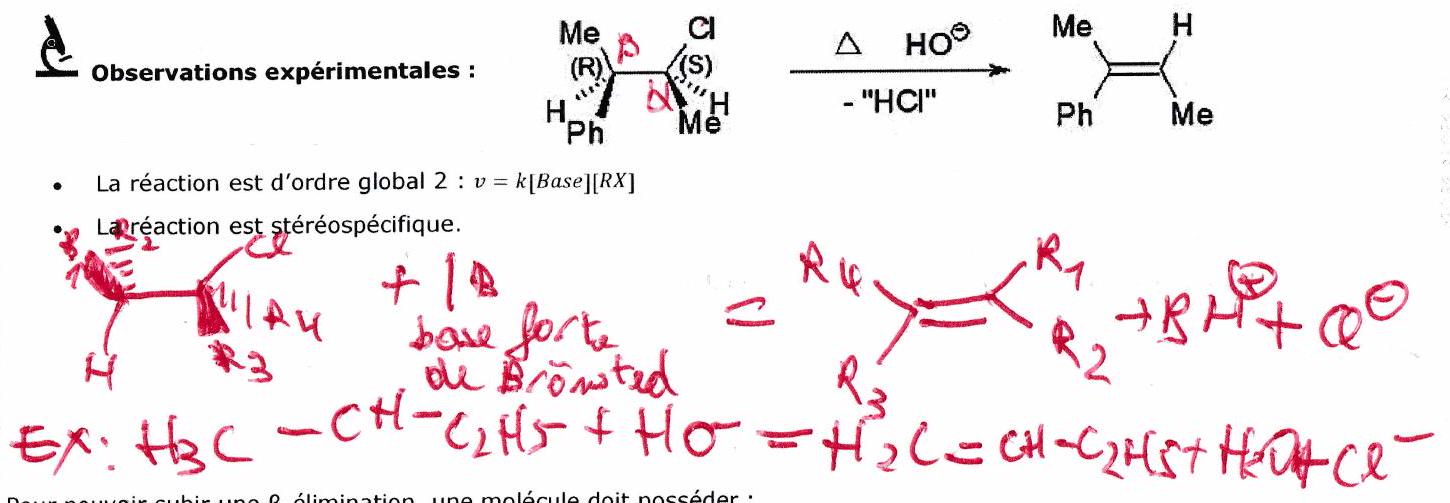
Résumé des observations expérimentales :
Un groupe électroattracteur porté par un tétraédrique : ici un halogène .
L’effet attracteur de se transmet de liaison en liaison (en s’atténuant) acide.
Exemple :
Profil réactionnel¶

Loi de vitesse : Ordre global 2, d’où le nom “”. (Bien que plus proche du réactif que du produit structurellement d’après Hammond)
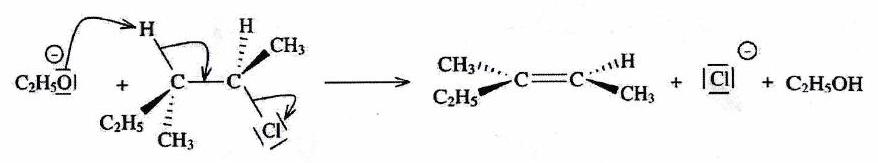
3.2 Mécanisme¶
3.3 Stéréosélectivité anti-périplanaire¶
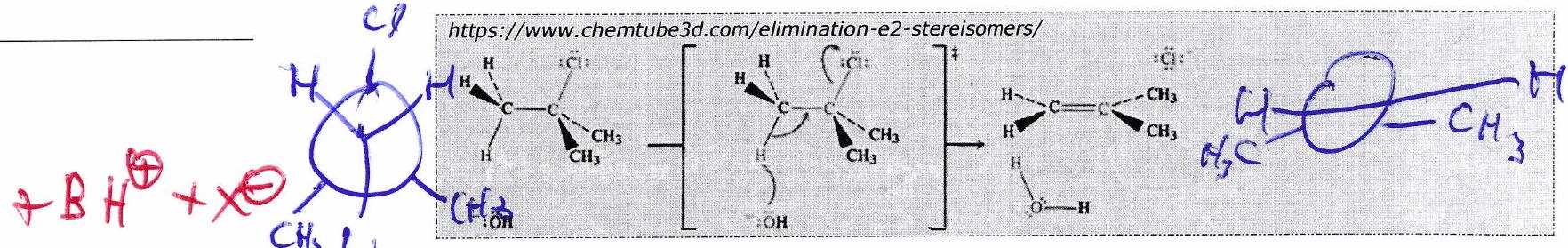
Le partant et le acide doivent être en position décalée ANTI (conformation anti-périplanaire) lors de l’élimination pour ne pas se gêner dans le complexe activé de l’état de transition (ET).
4 Compétition ¶
4.3 Influence du substrat¶

4.4 Bilan¶
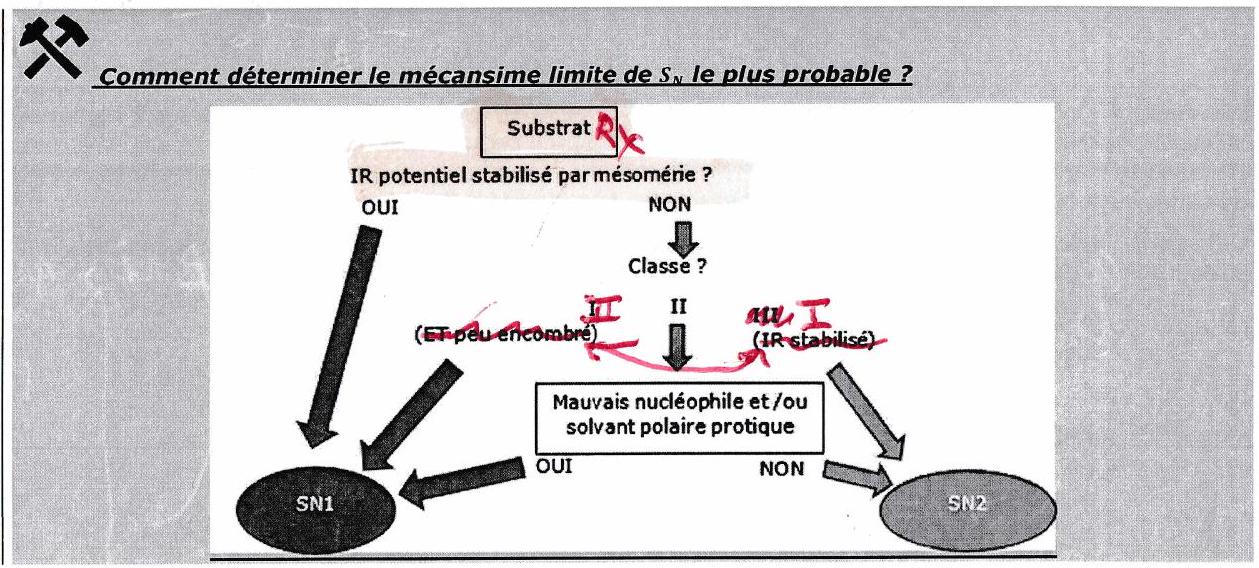
Comment déterminer le mécanisme limite ( ou ) le plus favorable selon les conditions expérimentales ?
En première approche :


Mais en réalité, c’est TRÈS COMPLIQUÉ de prévoir exactement ce qui va se passer : il y a BEAUCOUP de paramètres à prendre en compte, bien plus que ceux que l’on voit cette année (entre autres, il faudrait aussi regarder la nature du solvant, la force ionique...), et certains s’opposent entre eux...
Bref, on peut observer des résultats expérimentaux a priori inattendus.

Et donc ?
Pas de panique ! Si les données semblent contradictoires, on n’attend pas de vous que vous tranchiez tout(e) seul(e) : vous aurez d’autres indications. On vous demande surtout de savoir tenir un raisonnement cohérent sur l’influence des différents paramètres.
Par exemple, on donnera des résultats expérimentaux précisant le composé majoritaire : vous devrez expliquer pourquoi en choisissant l’argument qui va dans le sens observé.
Avez-vous tout compris ? ¶
Avez-vous tout compris ? ¶
5 Connaissances et compétences exigibles¶
| Je connais... | Je suis capable de... |
|---|---|
| Substitution nucléophile aliphatique : mécanismes limites et ; propriétés cinétiques et stéréochimiques. -élimination E2 : propriétés cinétiques et stéréochimiques, régiosélectivité. Compétitions substitution-élimination. | Analyser et justifier les choix expérimentaux dans une synthèse organique. Exploiter les notions de polarité et de polarisabilité pour analyser ou comparer la réactivité de différents substrats. Justifier le choix d’un mécanisme limite ou par des facteurs structuraux des substrats ou par des informations stéréochimiques sur le produit. Utiliser le postulat de Hammond pour interpréter l’influence de la stabilité du carbocation sur la vitesse d’une . Prévoir ou analyser la régiosélectivité, la stéréosélectivité et la stéréospécificité éventuelles d’une transformation simple en chimie organique (substitution nucléophile, -élimination E2) en utilisant un vocabulaire précis. Interpréter la formation de produits indésirables par la compétition entre les réactions de substitution et d’élimination. |
Table des matières¶
Les halogénoalcanes ..... 1 1.1 Définition ..... 1 1.2 Classes ..... 1 1.3 Propriétés physiques ..... 2 1.4 Réactivité ..... 2
Substitution nucléophile () ..... 3 2.1 Bilan général ..... 3 2.2 Utilisation des ..... 4 2.3 Mécanismes limites ..... 4 2.3.1 Substitution nucléophile monomoléculaire ..... 4 2.3.2 Substitution nucléophile bimoléculaire ..... 6 2.4 Compétition ..... 8 2.5 Transposition (ou réarrangement) de Wagner-Meerwein (HP) ..... 10
Réactions de -élimination E2 ..... 11 3.1 Bilan général ..... 11 3.2 Mécanisme ..... 11 3.3 Stéréosélectivité anti-périplanaire ..... 12 3.4 Régiosélectivité de Zaitsev (ou Saytsev ou Zaïtseff...) ..... 13
Compétition ..... 14 4.1 Influence de la température ..... 14 4.2 Influence du réactif ..... 14 4.3 Influence du substrat ..... 15 4.4 Bilan ..... 15