4 Les solvants
Une solution est obtenue par dissolution d’un composé chimique (le soluté) dans un liquide (le solvant).
4.1 Solvant moléculaire¶
Solvant : composé qui a la propriété de dissoudre d’autres substances pour former une solution homogène (une seule phase), sans provoquer de modification chimique de ces substances et sans lui-même se modifier.
Solvant moléculaire : les entités constitutives du solvant sont des molécules.
Solvant ionique : les entités constitutives du solvant sont des ions.
4.2 Processus de mise en solution¶
| Étapes | Nature du soluté : ionique | Nature du soluté : moléculaire |
|---|---|---|
| 1. Rupture des interactions soluté/soluté (ou dissociation) | Liaison ionique (forte) | Interactions de Van der Waals (VdW) ou Liaisons Hydrogène (LH) |
| 2. Établissement d’interactions soluté/solvant (ou solvatation) | Ion / dipôle | Interactions VdW ou LH |
Un soluté est soluble dans un solvant si la réalisation des processus de dispersion et de solvatation est favorable : il faut que
Règle empirique : « qui se ressemble s’assemble »
4.3 Catégories de solvants¶
4.3.1 Polarité¶
La polarité d’un solvant est définie par l’existence d’un moment dipolaire permanent.
| Solvants | Polaires | Apolaires |
|---|---|---|
| Exemples | Eau, Éthanol (groupe ), Étheroxyde | Hydrocarbures (cyclohexane, toluène), Éther de pétrole |
| ... dissolvent... | ... les solutés polaires (ex : ) ... les ions | ... les solutés moléculaires apolaires (ex : ) |
Les solvants fortement polaires créent un champ électrique suffisant pour ioniser : ils ont un fort pouvoir ionisant.
Les solvants polaires :
sont plutôt miscibles avec d’autres solvants polaires
solubilisent les molécules polaires
Les solvants apolaires :
sont plutôt miscibles avec d’autres solvants apolaires
solubilisent les molécules apolaires
4.3.2 Pouvoir dispersant¶
Le pouvoir dispersant (ou dissociant) du solvant est lié à la valeur de sa permittivité relative (ou constante diélectrique) (grandeur sans dimension).
Plus la permittivité relative est élevée, plus la force électrostatique entre les ions solvantés (force en ) est faible, et moins les ions de charge opposée auront tendance à se rassembler.
Pour : solvant totalement dispersant que des ions bien séparés et dans la solution.
Pour : solvant non dispersant les ions restent associés sous forme de paires d’ions (la couche de solvatation est commune aux deux ions dans le cas d’une paire d’ions).

4.3.3 Proticité¶
La proticité (ou caractère protique) est liée à la présence de dans la structure du solvant (le solvant doit être donneur de liaisons hydrogène LH).
Un solvant protique est nécessairement polaire.
4.3.4 Choix du solvant¶
Règle empirique : « Qui se ressemble s’assemble »
| Solvant | Formule | Permittivité relative | Polaire / Dissociant | Protique |
|---|---|---|---|---|
| Eau | ) | 78,5 |

| Oui | | Méthanol | | 30 | | Oui | | Éthanol | | 24,8 | | Oui | | Diméthylsulfoxyde (DMSO) |
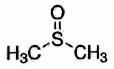
| 49 |
|

| | N,N-diméthylformamide (DMF) |
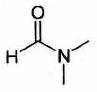
| 36,7 |

|

| | Propanone (acétone) |
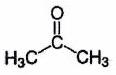
| 20,6 | ) |
|

| | Pyridine |
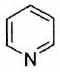
| 12,3 |
|

| | Éthanoate d’éthyle |
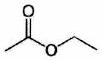
| 6,0 |

| ) |
| Tétrahydrofurane (THF) |
|
| Tétrahydrofurane (THF) |
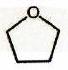
| 7,6 |

|

| | Diéthyléther |
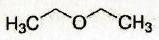
| 4,3 |

|

| | Dichlorométhane | | 9,0 |

|

| | Toluène |
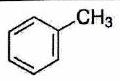
| 2,4 | ) |
| ) |
| Cyclohexane | | 2,0 |
|
| Cyclohexane | | 2,0 |
|

|
| Éther de pétrole | Mélange d’hydrocarbures | Faible | ) |
|

|
Ces exemples ne sont pas à connaître par cœur, mais il faut pouvoir en citer 1 ou 2 de chaque catégorie (sans les valeurs numériques !).
Discuter des solubilités relatives dans un solvant¶
Lister les interactions intermoléculaires pouvant s’établir entre chaque couple solvant/soluté.
Appliquer la règle du « qui se ressemble s’assemble ».
4.4 Cas de l’eau¶
L’eau en tant que solvant est :
Polaire (+++)
Protique (donneuse de LH par ses et aussi acceptrice de LH par les doublets non liants de l’atome )
Dispersante ()
Composés solubles dans l’eau¶
| Composés moléculaires | Doivent être polaires + idéalement former des LH (donneur et accepteur) avec l’eau |
|---|---|
| Solides ioniques (ou « sels ») | Cohésion assurée par les liaisons ioniques (interaction ion-ion). Processus de solvatation en deux étapes. |
Les solides ioniques sont toujours solubles dans l’eau. Les ions sont stabilisés par interaction ion-dipôle.
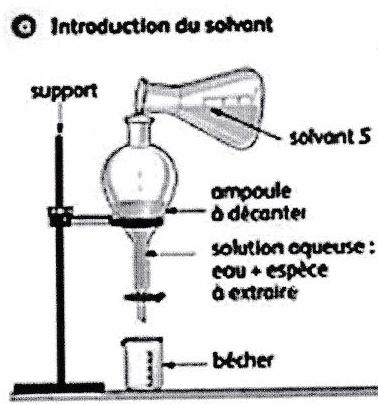
4.5 Extraction liquide-liquide (par solvant), lavage et relargage¶
L’opération d’extraction consiste à faire passer un composé d’un solvant vers un solvant ayant une meilleure affinité avec : on extrait par le solvant .
et doivent être non miscibles.
est choisi pour sa forte affinité avec et sa faible affinité pour les autres espèces présentes dans .
Avez-vous tout compris ? -
Cas de la Chromatographie sur Couche Mince¶
Séparation¶
Phase organique : solvant + espèce extraite.
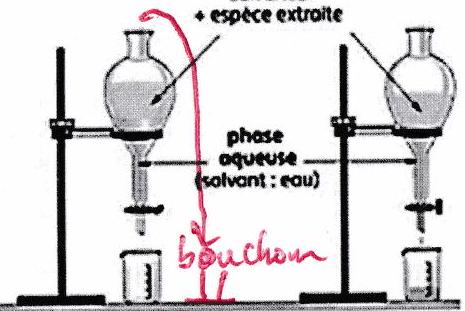

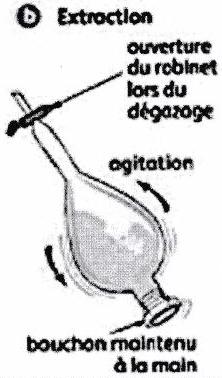
L’extraction liquide-liquide discontinue s’effectue par l’agitation vigoureuse du solvant et de la solution à extraire dans une ampoule à décanter.
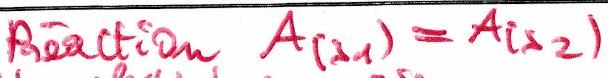
Détermination de la phase. Constante de partage :

L’un des 2 solvants est souvent de l’eau (phase aqueuse), l’autre est un solvant organique (phase organique).
Lavage de par le solvant : extraction dont le but est d’éliminer de la phase (ex : si est une impureté).
Relargage : méthode destinée à améliorer la séparation du produit organique entre une phase aqueuse et une phase organique lorsque la solubilité de dans l’eau n’est pas négligeable : on sature la phase aqueuse avec du chlorure de sodium . Les molécules d’eau quittent le composé moléculaire organique pour solvater les ions et . Le composé organique est alors beaucoup moins soluble en phase aqueuse et est « relargué » dans la phase organique (augmentation du rendement d’extraction).
4.6 Chromatographie¶
Chromatographie : Technique de séparation des constituants d’un mélange, basée sur leurs affinités respectives pour une phase stationnaire et une phase mobile.
Souvent utilisée avec un objectif analytique (parfois séparatif : pour séparer les constituants d’un mélange). Il existe de nombreux types de chromatographies, selon la nature des phases en présence.
| Chromatographie | Phase Mobile | Phase Stationnaire |
|---|---|---|
| Sur couche mince (CCM) | Liquide | Solide |
| En phase vapeur (CPV) | Gaz | Solide |
| Phase stationnaire | Phase mobile |
|---|---|
| Souvent un gel de silice () sur un support rigide. |
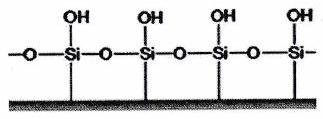
Polaire.
Donneuse et acceptrice de liaisons H. | Solvant (éluant) qui migre sur la plaque de silice. Selon la polarité souhaitée :
- Solvants apolaires : hexane, éther de pétrole (mélange d’alcanes)...
- Solvants polaires : éther, éthanol... |
Cf. poly « les Bons Gestes en TP »
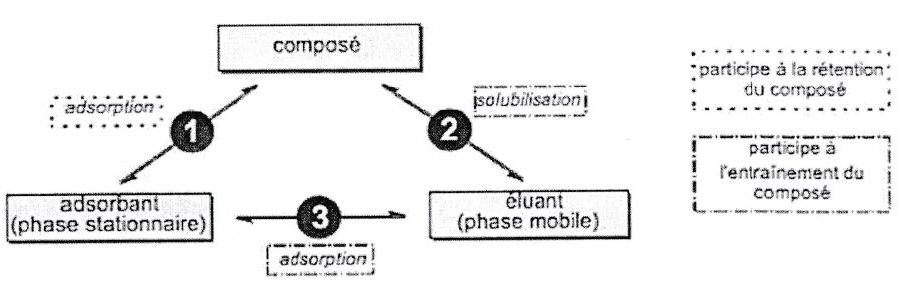
Le choix de l’éluant est primordial : il permet d’assurer une séparation plus ou moins efficace des différents constituants à analyser.
| Éluant \ Composé | Apolaire | Polaire |
|---|---|---|
| Apolaire | (2) >> (1) et (3) migre légèrement (solubilisé par l’éluant mais ce dernier monte mal sur la silice). | (1) >> (2) et (3) ne migre pas (s’adsorbe sur la silice avec laquelle il a beaucoup plus d’affinité qu’avec l’éluant qui a du mal à monter). |
| Polaire | (3) >> (2) et (1) migre beaucoup (peu retenu par la silice et chassé par l’éluant qui occupe les sites d’adsorption). | migre légèrement (solubilisé par l’éluant, retenu par la silice ; mais en compétition avec l’éluant sur les sites d’adsorption). |
Comparer l’effet d’un éluant ou la migration de composés¶
Pour un même composé : la migration est d’autant plus importante que l’éluant est polaire et protique (car l’éluant prend les sites d’adsorption sur la silice, et donc « chasse » le composé qui n’a plus de place pour s’y fixer).
Pour un même éluant : le composé migre d’autant plus qu’il est apolaire aprotique (moins retenu par la silice).
Avez-vous tout compris ? - Avez-vous tout compris ? -
4.7 Notions de Chimie Verte¶
La plupart des solvants sont des Composés Organiques Volatils (COV) :
grande inflammabilité ;
effet toxique sur la santé et l’environnement (dispersion dans l’atmosphère) ;
participation à l’effet de serre.
Chimie verte : concept émergent aux EU dans les années 90 : 12 « principes »

Utiliser des solvants et des conditions de réactions plus sûrs : différents critères :
faible toxicité et limitation des risques d’incendie ou d’explosion,
faible réactivité,
recyclable,
faible coût énergétique
Parmi les alternatives à l’utilisation des COV comme solvants, les recherches actuelles privilégient :
les réactions sans solvant : procédés industriels en phase gazeuse et catalyse solide ;
les fluides supercritiques : utilisation de supercritique.
l’eau solvant : disponibilité et non-toxicité mais faible solubilité des composés organiques et purification par distillation énergétiquement coûteuse ;
les liquides ioniques : composés ioniques à faible point de fusion () ; utilisés comme solvants très peu volatils et faciles à recycler ;
5 Hydrophilie, hydrophobie, amphiphilie¶
5.1 Définitions¶
Les composés apolaires (associés par liaisons de London) sont insolubles dans l’eau : Composés « hydrophobes » ou « lipophiles » (ex : hydrocarbures) Les composés polaires, associés par liaisons hydrogène, et les ions sont solubles dans l’eau ; Composés « hydrophiles ».
Lors d’une extraction liquide-liquide : « constante de partage » Si est davantage soluble en phase aqueuse est hydrophile Si est davantage soluble en phase organique est hydrophobe
5.2 Composé amphiphile¶
5.2.1 Définition¶
Composé amphiphile (ou tensioactif) : possède à la fois un fort caractère hydrophile et un fort caractère hydrophobe. Aussi appelés émulsifiant ou surfactant.
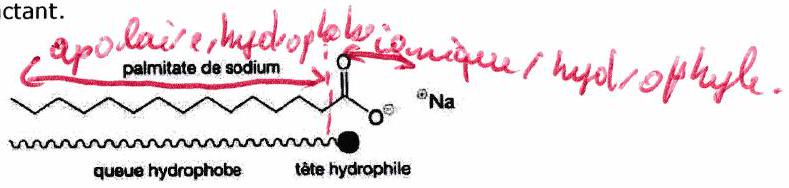
Un composé amphiphile contient :
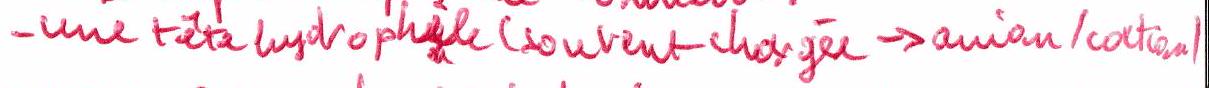
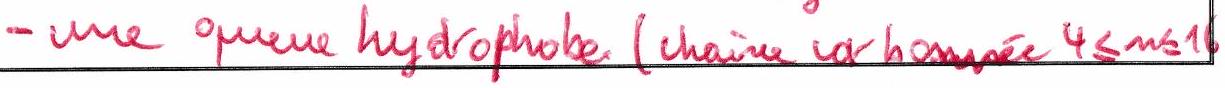
5.2.2 Propriété émulsifiante des composés amphiphiles¶
Une phase hydrophile et une phase hydrophobe cherchent à minimiser leur surface de contact. Les tensioactifs stabilisent l’interface en s’y plaçant :
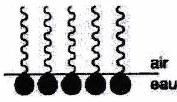
Augmentation de la surface de contact entre les deux phases formation d’une émulsion : mélange hétérogène de deux substances liquides non miscibles, l’une étant dispersée sous forme de petites gouttelettes dans l’autre.

Les tensioactifs font baisser la « tension superficielle » ou « tension de surface » (force qui tend à diminuer l’aire de l’interface).
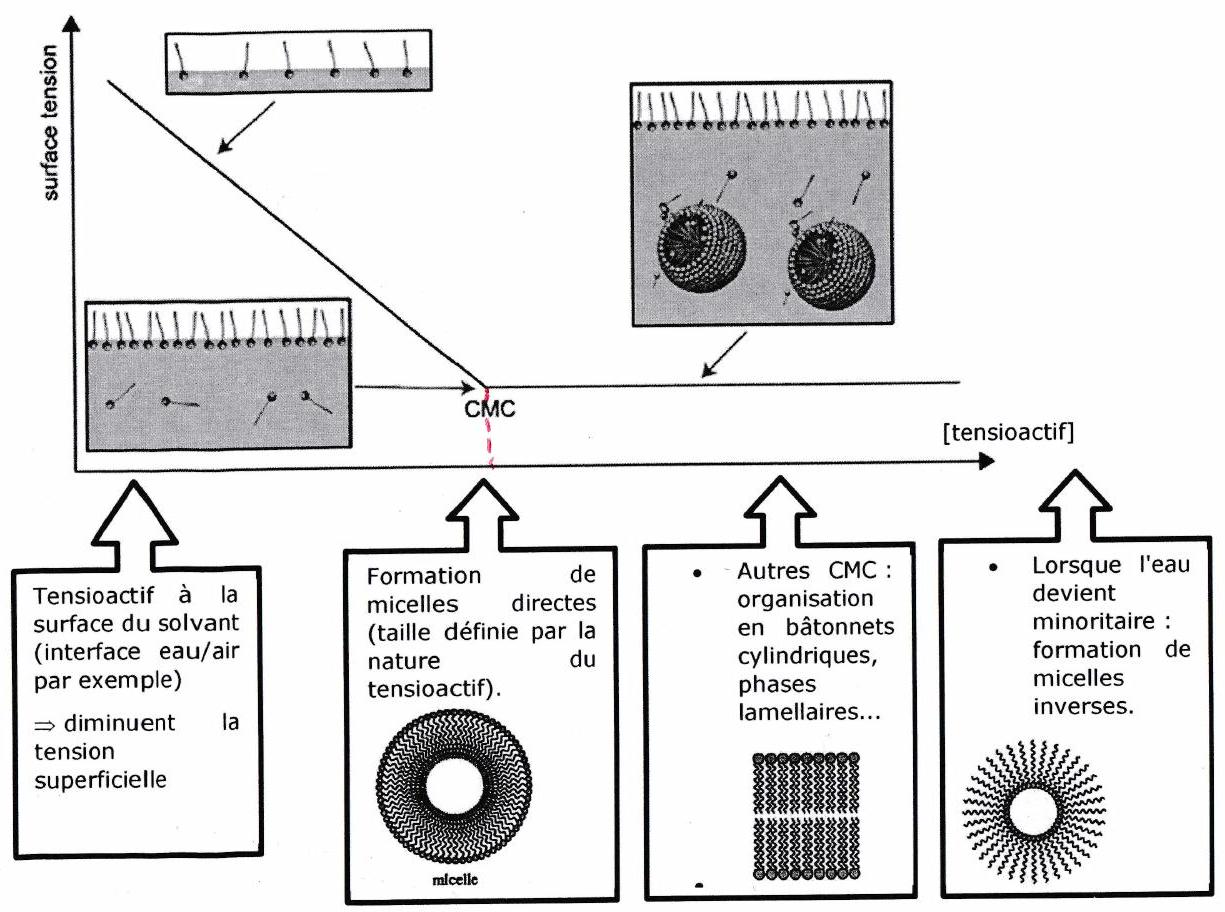
5.2.3 Concentration Micellaire Critique (CMC)¶
L’organisation des tensioactifs dans une solution est fortement dépendante de leur concentration et de la température. CMC : concentration en tensioactif dans un milieu à partir de laquelle les micelles se forment de façon spontanée.
5.3 Propriétés des détergents¶
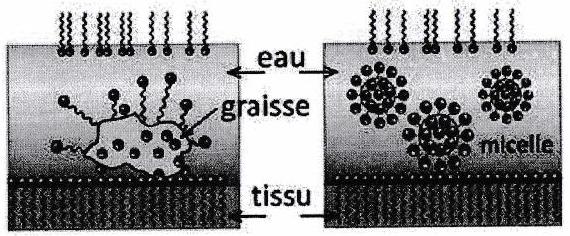
Les composés hydrophobes peuvent se solubiliser à l’intérieur de la micelle.
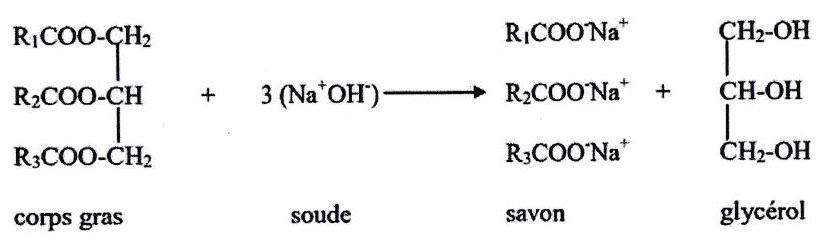
Fabrication des savons : réaction de saponification (cf. orga de PC)
Influence du milieu sur l’efficacité de la détergence En présence d’ions calcium ou d’ions magnésium (eau dure), l’efficacité détergente d’un savon diminue (formation de précipités).
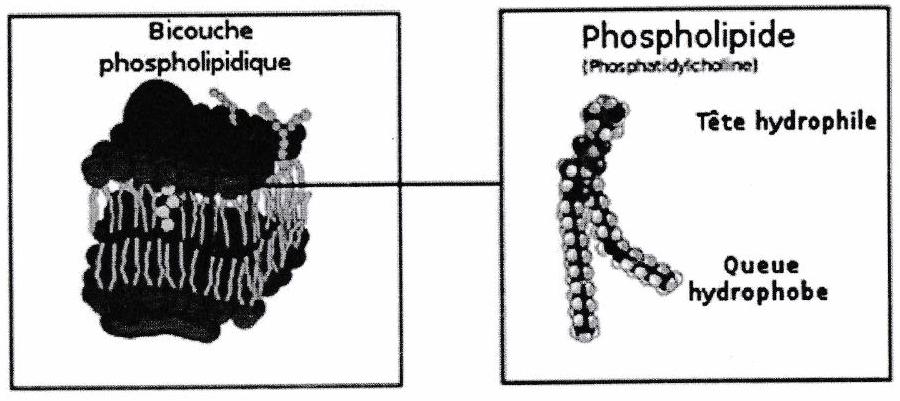
5.4 Membrane cellulaire¶
Bicouche lipidique : La membrane plasmique comprend trois classes de lipides amphiphiles : les phospholipides (les plus abondants), les glycolipides et les stérols.
6 À l’issue du chapitre...¶
| Connaissances | Compétences |
|---|---|
| Électronégativité : liaison polarisée, moment dipolaire, molécule polaire. | Comparer les électronégativités de deux atomes à partir de données ou de leurs positions dans le tableau périodique. |
| Interactions de van der Waals, polarisabilité. | Prévoir la polarisation d’une liaison à partir des électronégativités comparées des deux atomes mis en jeu. |
| Liaison hydrogène (interaction par pont hydrogène). | Relier l’existence ou non d’un moment dipolaire permanent à la structure géométrique d’une molécule. |
| Ordres de grandeur énergétiques des interactions entre entités | Déterminer direction et sens du vecteur moment dipolaire d’une liaison ou d’une molécule. |
| Température de changement d’état de corps purs moléculaires. Activité optique, pouvoir rotatoire, loi de Biot. | Lier la polarisabilité d’un atome à sa position dans le tableau périodique. Lier qualitativement la valeur des énergies d’interactions intermoléculaires à la polarité et la polarisabilité des molécules. Prévoir ou interpréter les températures de changement d’état de corps purs moléculaires par l’existence d’interactions de van der Waals ou de liaisons hydrogène. Relier la valeur du pouvoir rotatoire à la composition d’un mélange de stéréoisomères. Déterminer la composition d’un système chimique ou suivre une transformation chimique en utilisant l’activité optique. |
| Espèces chimiques amphiphiles, micelles, structure schématique des membranes cellulaires. Émulsions. | Solubilité, miscibilité Grandeurs caractéristiques et propriétés de solvants moléculaires : moment dipolaire, permittivité relative, caractère protogène. |