Chap. 3 : Structure des molécules organiques - Stéréochimie
EXERCICES¶
Les « Avez-vous tout compris » ?¶
Avez-vous tout compris ? - ¶
Déterminer le nombre d’insaturations dans les composés suivants :
caféine
Avez-vous tout compris ? - ¶
Nommer les molécules suivantes :
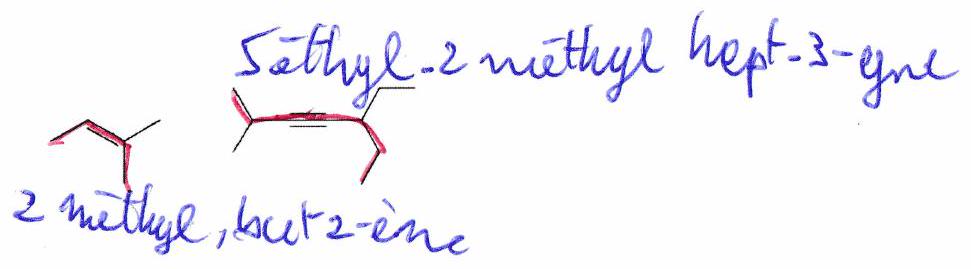
Avez-vous tout compris ? - ¶
Donner le nom (en nomenclature systématique) des molécules suivantes :
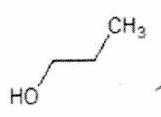
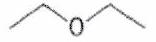
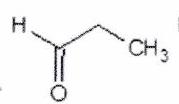
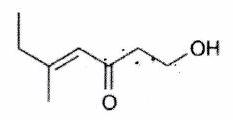
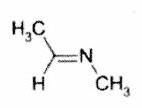
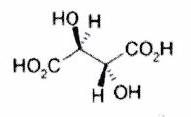
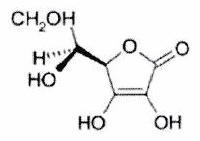
Représenter la molécule suivante en Cram :
Avez-vous tout compris ? - ¶
Indiquer si les molécules suivantes sont chirales ou non. Justifier.
Avez-vous tout compris ? - ¶
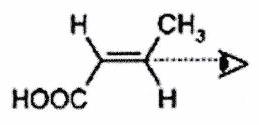
Combien de stéréoisomères de configuration la molécule suivante possède-t-elle ?
Avez-vous tout compris ? - ¶
Quelle est la relation stéréochimique entre les deux molécules suivantes ?
C@HH1O](https://
C@HH1O](https://
Avez-vous tout compris ? - ¶
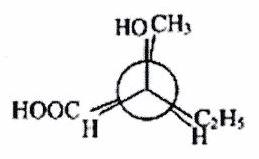
Représenter les molécules suivantes en Newman :
Exercices en autonomie¶
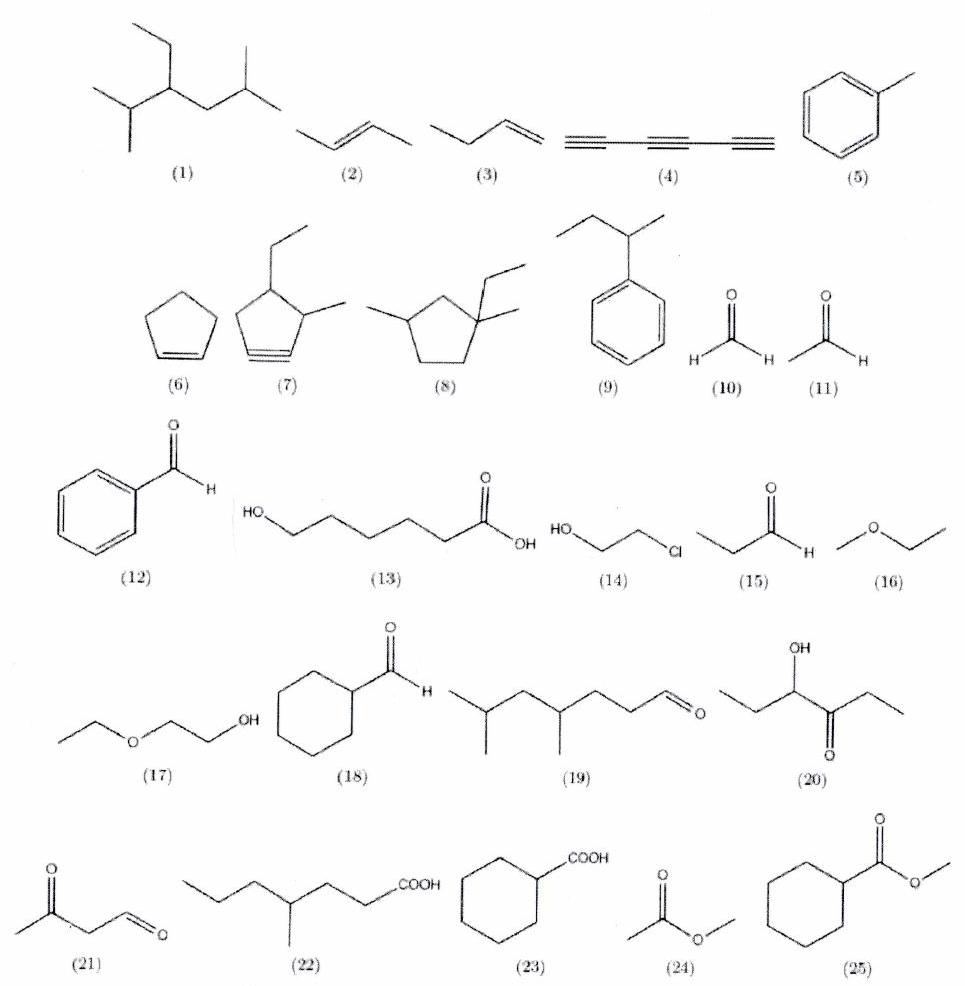
EXERCICE 1 : Nomenclature : trouver le nom à partir de la formule topologique (*)¶
Nommer les molécules suivantes :
EXERCICE 2 : Nomenclature : trouver la formule à partir du nom¶
Donner les représentations développées, semi-développées et topologiques des molécules suivantes : a) Méthylpropane b) 2-méthylbutane c) 3,6-diéthyl-4,5-diméthyldécane d) 3-isopropylheptane e) 3-tertiobutyl-4-méthylheptane f) penta-1,3-diène g) Acide 2-amino-3-méthylbutanoïque h) déca-2,4,6-triène i) 2-méthyl-3-(2’-propylphényl)propan-1-ol j) 3-méthylpent-1-yne k) but-3-ène-1,2-diamine l) hex-4-yn-3-amine
EXERCICE 3 : Nombre d’insaturations (*)¶
Déterminer le nombre d’insaturations dans les composés suivants :
(nitrobenzène)
EXERCICE 4 : Représentation spatiale des molécules (*)¶
Donner la représentation en projection de Newman suivant l’axe indiqué sur la figure des molécules données ici en représentation de Cram. On respectera la conformation.
a)
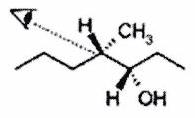
b)
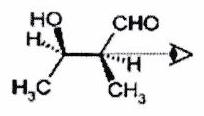
Donner la représentation de Cram des molécules suivantes, dessinées en projection de Newman. On respectera la conformation.
a)
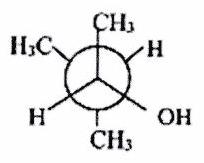
b)
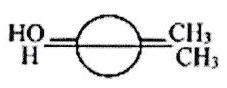
EXERCICE 5 : Conformation de composés linéaires (**)¶
Écrire, en projection de Newman, la conformation la plus stable et la conformation la moins stable du 1,2-dichloroéthane.
On considère la molécule de 2-méthylbutane. Représenter l’allure de la courbe de variation de l’énergie potentielle de la molécule en fonction de l’angle dièdre pour des rotations autour de l’axe .
Expliquer pourquoi la conformation la plus stable du 2-fluoroéthanol est la conformation décalée gauche.
EXERCICE 6 : Descripteurs stéréochimiques (*)¶
Attribuer le descripteur stéréochimique ou à chaque atome de carbone asymétrique dans les molécules ci-après.
a)
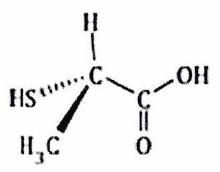
b)
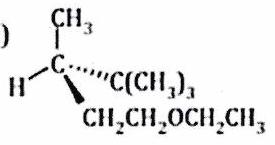
c)
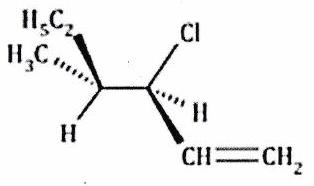
Représenter la molécule c) en projection de Newman, dans l’axe de la liaison entre les deux atomes de carbone asymétriques, celui portant le chlore étant au premier plan.
EXERCICE 7 : Acide domoïque (**)¶
L’acide domoïque, représenté ci-contre, est le principal responsable des intoxications amnésiques par ingestion de fruits de mer. Il se fixe sur des récepteurs spécifiques du cerveau, exerçant ainsi une action neuroexcitatrice.
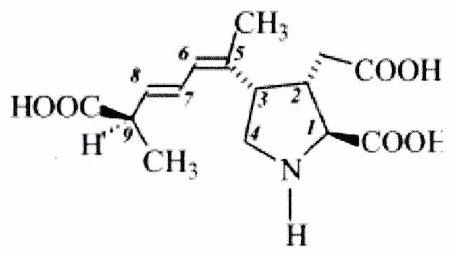
Indiquer la configuration absolue des atomes de carbones asymétriques (en précisant l’ordre de priorité des différents substituants), ainsi que celles des doubles liaisons.
Quel est le nombre total de stéréoisomères de l’acide domoïque ?
Dessiner l’énantiomère de cet acide et indiquer sa configuration absolue.
EXERCICE 8 : Relations stéréochimiques (**)¶
Représenter l’ensemble des stéréoisomères des composés suivants. Dans chaque cas, préciser les relations existant entre les différents stéréoisomères et les propriétés optiques de chacun.
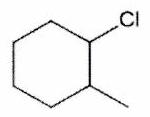
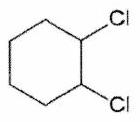
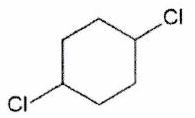
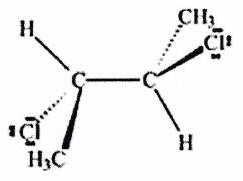
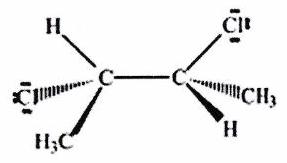
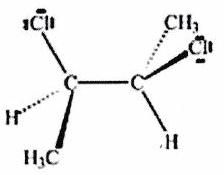
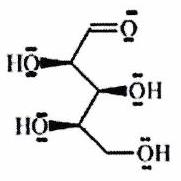
Parmi les molécules suivantes, indiquer les couples de diastéréoisomères, d’énantiomères et de stéréoisomères de conformation.
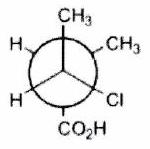
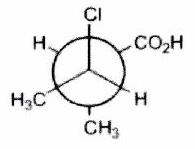
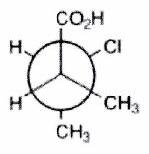
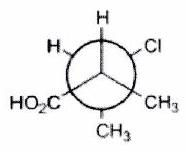
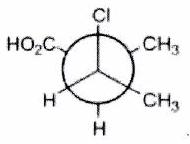
Pour chaque ligne, indiquer la relation qui existe entre les molécules.
![C([18OH])C@HC@HC[18OH]</smiles>](../build/31cc9a4c4dd927d89afdfcea0a2be90a.jpeg)
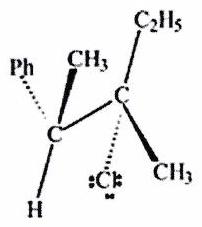
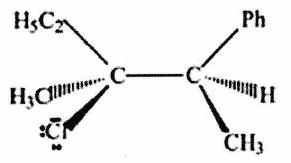
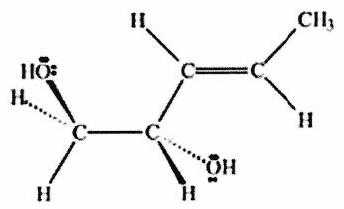
(%5BHg%5D)C=CC%3C/smiles%3E%5D(https://cdn.mathpix.com/cropped/6b4546c8-9bcb-4c92-bb28-4253bae3299d-3.jpg?height=199&width=323&top_left_y=1676&top_left_x=2224))
EXERCICE 9 : Pouvoir rotatoire (**)¶
L’adrénaline naturelle, pour laquelle , est employée en médecine. Son énantiomère est toxique. Un pharmacien reçoit une solution qui est censée contenir d’adrénaline dans de solution, mais dont la pureté optique n’est pas assurée. En plaçant la solution dans un polarimètre (dans une cuve de de long), il observe un angle de .
L’adrénaline naturelle est-elle dextrogyre ou lévogyre ?
Son stéréodescripteur est-il ou ?
Est-il prudent d’employer cette solution comme médicament ?
Quelle est la concentration de chaque énantiomère de l’adrénaline ?
On définit l’excès énantiomérique par :
5. Quel est l’excès énantiomérique de la solution considérée ?
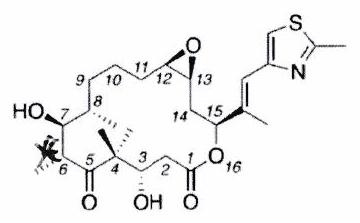
EXERCICE 10 : L’épothilone A (***)¶
Les épothilones constituent une nouvelle classe de molécules macrocycliques cytotoxiques à 16 chaînons au fort potentiel en chimiothérapie. Plusieurs épothilones sont actuellement en cours de développement clinique pour le traitement du cancer.
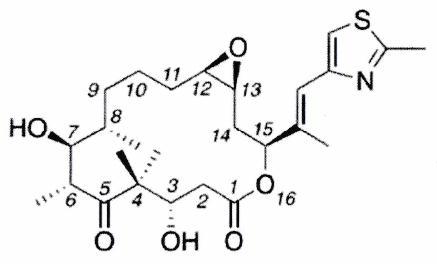
épothilone A
Identifier tous les éléments stéréogènes de l’épothilone A et déterminer le nombre de stéréoisomères de configuration différents de l’épothilone A. Justifier la réponse.
Attribuer, en justifiant la réponse, le descripteur stéréochimique : 2.1. de la double liaison carbone-carbone hors du cycle de l’épothilone A. 2.2. du carbone 7.