Chapitre 3 : Structure des entités chimiques en Chimie Organique Stéréochimie
Chimie organique : Domaine de la chimie portant sur des molécules principalement constituées de carbone et d’hydrogène.
Hétéroatome : atome autre que C et H (N, O, Cl...)
1. Aperçu de nomenclature en chimie organique¶
1.1 Principes généraux¶
Nomenclature officielle (ou systématique) : règles internationales fixées par l’IUPAC (International Union of Pure and Applied Chemistry).
Racine : établie avec la chaîne carbonée principale (la plus longue ou comportant la fonction principale).
Préfixes et suffixes (avec indices numériques) : indiquent la nature et la position sur la chaîne des atomes ou groupes particuliers.
1.2 Les hydrocarbures saturés¶
Nom générique : ALCANES (symbole ) Formule générale :
1.2.1 Les alcanes linéaires¶
Racine indiquant le nombre de carbone de leur chaîne suivi de la terminaison -ane.
| Nombre de carbone | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| Racine | méth- | éth- | prop- | but- | pent- | hex- | hept- | oct- | non- | déc- |
1.2.2 Les alcanes ramifiés¶
Groupe ALKYLE (symbole )
Formule générale :
Obtenu par retrait d’un atome H d’un alcane substituant (= ramification) d’une chaîne carbonée principale.
Nomenclature : obtenue en remplaçant la terminaison -ane de l’alcane par la terminaison -yle.
Exemples : : méthyle ; : hexyle.
Pour nommer un alcane ramifié :
Chercher le plus long enchaînement carboné chaîne principale que l’on nomme en fonction du nombre de C.
Identifier les substituants alkyles : le ou les groupe(s) alkyle(s) de la chaîne principale et on énonce son ou (leurs) nom(s) devant celui de la chaîne principale.
Déterminer la position de chaque substituant sur la chaîne principale en numérotant les carbones de celle-ci et on indique cette position en faisant précéder le nom de chaque substituant d’un indice de position.
S’il n’y a qu’un seul substituant, le sens de numérotage de la chaîne principale est choisi de telle sorte que son indice de position soit le plus petit possible.
S’il y a plusieurs substituants, le sens de numérotage est choisi de telle sorte que l’indice du carbone porteur de la première ramification soit minimal.
Les composantes du nom d’un hydrocarbure (parties littérales, indice de position) sont toutes liées par des tirets.
Si un même groupe alkyle se trouve deux ou plusieurs fois en position de substituant sur la chaîne principale, on le fait précéder d’un préfixe multiplicateur : di, tri, tétra, penta, etc. (Ce préfixe n’est pas pris en compte pour le classement par ordre alphabétique).
Les indices de position multiples pour un même type de substituant sont séparés par des virgules (exemple : 3-éthyl-4,5-diméthylheptane).
Quelques noms de substituants à retenir :
| Structure (topologique) | Nom usuel | Symbole | Structure (topologique) | Nom usuel | Symbole |
|---|---|---|---|---|---|
![<smiles>[R]CCCCCCC([R])[R]</smiles>](../build/267420653d1efa6ba49d64c667e034ea.jpeg) | n-propyle | nPr | ![<smiles>[R]C(C)C</smiles>](../build/6e2e705609b65ca2e5e6a0b14c6297e0.jpeg) | isopropyle | iPr |
Exemples :
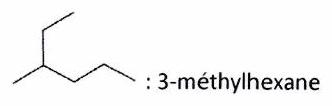
1 insaturation :
1 liaison double ()
1 cycle
1.3 Les insaturations¶
1.3.1 Définition¶

2 insaturations :
1 liaison triple
Ou insaturation
4 insaturations :
Penser au phényle !
Pour déterminer le nombre d’insaturations à partir de la formule brute : 2 méthodes
Méthode 1 : Écrire la chaîne la plus saturée possible (sans cycle ni liaisons multiples) avec les C et hétéroatomes, puis compter les H que l’on peut ajouter au maximum ().
Méthode 2 : Appliquer la formule tenant compte de la valence des atomes :
Avec :
le nombre d’atomes tétravalents (ex : C),
le nombre d’atomes trivalents (ex : N),
le nombre d’atomes monovalents (ex : halogènes).
Le nombre d’atomes divalents (ex : O) n’intervient pas dans le calcul du nombre d’insaturations.
Avez-vous tout compris ? -
Compétence : Déterminer le nombre d’insaturations d’une molécule à partir de sa formule brute ou de sa formule topologique.
1.3.2 Les hydrocarbures acycliques insaturés¶
ALCÈNES s’ils comportent une double liaison
ALCYNES s’ils comportent une triple liaison
Nomenclature : à partir de l’alcane ayant le même squelette carboné, en remplaçant la terminaison -ane par la terminaison -ène pour les alcènes et -yne pour les alcynes (précédé de l’indice de position).
La chaîne principale n’est pas nécessairement la plus longue (comme il est de règle pour les alcanes) : c’est la plus longue des chaînes contenant la double ou la triple liaison.
La double ou triple liaison a priorité sur les substituants pour le choix du sens de numérotage : celui-ci doit obligatoirement donner à la liaison insaturée le plus petit indice de position possible.
Avez-vous tout compris ? -
Compétence : Nommer (en nomenclature systématique) les hydrocarbures suivants.
1.4 Groupes caractéristiques¶
Groupe caractéristique (ou groupe fonctionnel) : Atome ou groupe d’atomes comportant un ou plusieurs hétéroatomes, introduit sur une chaîne carbonée conférant à la molécule des propriétés chimiques caractéristiques.
Classe fonctionnelle (ou fonction chimique) : Ensemble de composés possédant le même groupe caractéristique (éventuellement avec la restriction d’un même environnement). Exemple : Les composés comportant le groupe hydroxyle -OH relié à un atome de carbone tétragonal constituent la classe des alcools.
Le carbone portant le groupe caractéristique est appelé carbone fonctionnel.
La formule semi-développée fait généralement apparaître les groupes caractéristiques.
Les groupes caractéristiques sont classés dans un ordre de priorité décroissante.
Le groupe prioritaire, dit groupe principal, est désigné par un suffixe.
Tous les autres groupes caractéristiques sont désignés par des préfixes.
L’ordre de classement des groupes caractéristiques se fait par oxydation décroissante : la fonction la plus oxydée est prioritaire.
| Fonction | Structure | Suffixe | Préfixe | Priorité |
|---|---|---|---|---|
| Acide carboxylique | ![<smiles>[R]C(=O)O</smiles>](../build/b9ab775c4cf311ca9b6f3f44f2cec073.jpeg) | acide ...-oïque | - | 1 |
| Anhydride d’acide | ![<smiles>[R]C(=[O+])OC([R])[O-]</smiles>](../build/1c04a7e083efdf5beaa19f93debfe7ba.jpeg) | anhydride ...-oïque | - | 2 |
| Ester | ![<smiles>[R]OC([R])=[O+][O-]</smiles>](../build/223cb16a324a4c732e47d27d60e119e7.jpeg) | ...-oate de ...-yle | - | 3 |
| Halogénure d’acyle | ![<smiles>[R]C([Y])[O-]</smiles>](../build/0b375b7f92c5d0c1f5e19cdf0e7bf9ef.jpeg) | halogénure de ...-oyle | - | 4 |
| Amide |
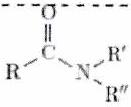
| ...-amide | - | 5 | | Nitrile | | ...-nitrile | -cyano- | 6 | | Aldéhyde |

![[R]C([2H])O+ | ...-al | -oxo- (ou -formyl-) | 7 | | Cétone |

![<smiles>[R]C([R])[O+]C</smiles>](../build/55d084664d374a0668b93ae5e0576957.jpeg) | ...-one | -oxo- | 8 |
| Alcool | | ...-ol | -hydroxy- | 9 |
| Phénol | | ...-phénol | -hydroxy- | 10 |
| Amine |
| ...-one | -oxo- | 8 |
| Alcool | | ...-ol | -hydroxy- | 9 |
| Phénol | | ...-phénol | -hydroxy- | 10 |
| Amine | ![<smiles>[Y7]N([R])[Te]</smiles>](../build/f7f81d4a8c170cc3fae3c3e3f182ca9d.jpeg) | ...-amine | -amino- | 11 |
| Étheroxyde |
| ...-amine | -amino- | 11 |
| Étheroxyde | ![<smiles>[R]O[R]</smiles>](../build/e90c7a8fd8959cc189c4a9bdcd267e7a.jpeg) | ...oxy... | -alkoxy- | 12 |
| Halogénoalcane | | - | halogéno- | 13 |
| Nitro | | - | nitro- | 14 |
| Alcyne | | -yne | - | - |
| Alcène |
| ...oxy... | -alkoxy- | 12 |
| Halogénoalcane | | - | halogéno- | 13 |
| Nitro | | - | nitro- | 14 |
| Alcyne | | -yne | - | - |
| Alcène | ![<smiles>[R1]C1[Z5]C([R1])C1[Z15]</smiles>](../build/71219160d21d5aac39461cb94349bd5f.jpeg) | -ène | - | - |
| -ène | - | - |
Nommer une molécule organique : bilan :
Rechercher toutes les fonctions de la molécule.
Identifier la fonction prioritaire (ou groupe fonctionnel principal). Les autres fonctions deviennent des substituants.
Rechercher la chaîne carbonée principale (critères dans l’ordre suivant) :
(1) : contient la fonction prioritaire.
(2) : contient le maximum de doubles et de triples liaisons.
(3) : possède la chaîne carbonée la plus longue.
(4) : porte un maximum de substituants.
Numéroter la chaîne principale. Le groupe fonctionnel principal doit avoir le plus petit indice possible. En cas de choix, les liaisons multiples doivent avoir les plus petits indices possibles. Si on a encore le choix, c’est l’ensemble d’indices le plus petit possible qui est retenu.
Nommer les différents substituants et les classer. Les substituants sont rangés par ordre alphabétique. Les préfixes multiplicatifs n’altèrent pas l’ordre alphabétique établi.
Nommer la molécule en ordonnant les informations.
Stéréochimie - Indice 1 - Préfixe du groupe 1 - Indice 2 - Préfixe du groupe 2 -... - Racine de la chaîne principale - Indices d’insaturation - Suffixe d’insaturation - Indice de la fonction principale - Suffixe du groupe caractéristique
Quelques points de syntaxe à retenir :¶
Il n’y a jamais d’espace dans un nom, sauf « acide carboxylique » et pour les esters (« éthanoate d’éthyle » par exemple).
Les chiffres consécutifs sont séparés par une virgule.
Les lettres et les chiffres sont séparés par un tiret.
Si on « enlève » les chiffres dans le nom principal (sans tenir compte des substituants), on ne doit pas avoir 2 consonnes ou 2 voyelles qui se suivent. On écrira par exemple butan-1-ol mais butane-1,2-diol.
Exemple :¶
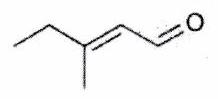

Avez-vous tout compris ? - ¶
Objectif : Nommer (en nomenclature systématique) les molécules organiques monofonctionnelles suivantes.
3.1 Définition¶
Une rotation est possible autour d’une liaison simple .
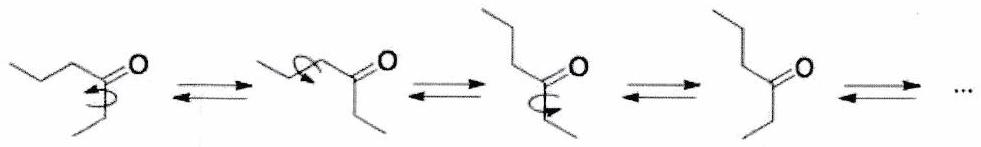
Pas de rotation possible autour de liaisons multiples :

3.2 Stabilité relative selon l’angle de rotation (angle dièdre)¶
: angle dièdre ou angle de torsion
Exemple de l’éthane

Conformation décalée : gêne stérique (= répulsion électrostatique entre nuages électroniques) minimale entre les électrons des liaisons ( plus éloignés) la plus stable.
Conformation éclipsée : gêne stérique maximale entre les électrons des liaisons la moins stable.
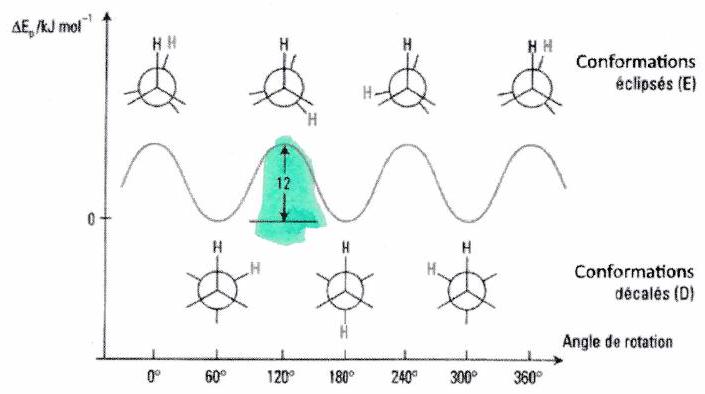
Analyse énergétique de la rotation¶
À (agitation thermique) : même ordre de grandeur que la barrière () : la molécule d’éthane a suffisamment d’énergie pour passer d’une conformation à l’autre.
Il y a équilibre dynamique entre les conformations : une espèce chimique passe en permanence d’un stéréoisomère de conformation à l’autre.
Les différents stéréoisomères de conformation (non isolables) représentent donc une seule espèce chimique.
À ambiante, des molécules d’éthane sont en conformation décalée.
Exemple du butane
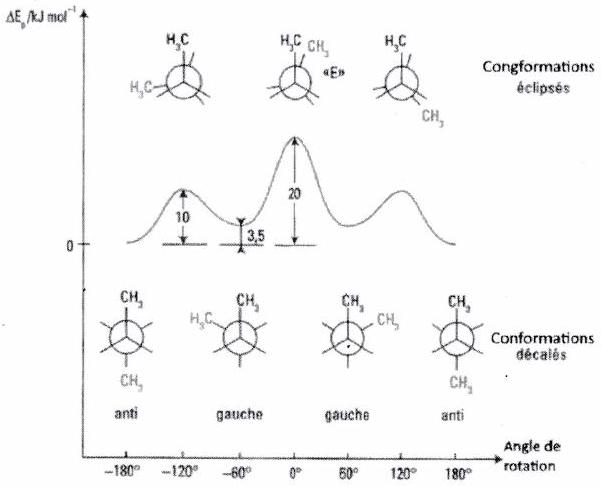
Les conformations stables (conformères) sont les conformations décalées :
La conformation anti (angle dièdre entre les groupes méthyle), la plus stable (répulsion stérique entre groupes méthyle minimisée).
Les deux conformations gauches (angle dièdre ou ), moins stables que l’anti en raison de la proximité des groupes méthyle (répulsion stérique).
4 Stéréoisomérie de configuration¶
4.1 Définition¶
Deux stéréoisomères non stéréoisomères de conformation sont des stéréoisomères de configuration. Le passage d’un stéréoisomère de configuration à l’autre nécessite la rupture d’une liaison covalente.
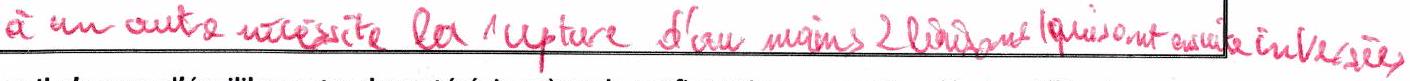
Il n’y a pas d’équilibre entre deux stéréoisomères de configuration : ce sont 2 molécules différentes.
4.2 Centre stéréogène (ou stéréocentre)¶
Définition : Atome ou groupe d’atomes stéréogène : groupe dont la permutation de deux substituants génère deux stéréoisomères de configuration.
Exemples de centres stéréogènes :
Atome asymétrique : Atome ayant une figure de répulsion , avec 4 substituants différents. Très souvent : c’est un atome de carbone : on parle de carbone asymétrique noté (mais il existe aussi des atomes asymétriques de )

Double liaison , chaque ayant 2 substituants différents.
4.3 Règles séquentielles de Cahn, Ingold et Prelog (CIP)¶
Les règles séquentielles CIP (Cahn Ingold Prélog) permettent de classer les substituants d’un centre stéréogène.

Exemple :¶
Classement CIP des substituants autour du carbone central :
4.4 Énantiomérie¶
4.4.1 Chiralité des molécules¶
Chiralité : propriété d’un objet ou d’une molécule d’être non superposable à son image dans un miroir plan.
Exemple :¶
Énantiomérie : relation entre 2 molécules chirales, images l’une de l’autre dans un miroir plan mais non superposables.
si deux molécules sont images l’une de l’autre et superposables, il s’agit en fait de la même molécule ! Elle est donc achirale.
Une molécule chirale ne possède aucun centre ni plan de symétrie. Si une structure possède un plan ou un centre de symétrie, elle est achirale.
Avez-vous tout compris ? - ¶
Compétence : Identifier une molécule chirale
4.4.2 Configuration absolue d’un atome asymétrique¶
décrite par des stéréodescripteurs (ou descripteurs stéréochimiques) ou .
Comment déterminer la configuration absolue (ou attribuer le stéréodescripteur) d’un :
Classer les substituants de l’atome stéréogène (ex : ) selon les règles séquentielles CIP.
Orienter la molécule de façon à disposer le substituant vers l’arrière.
Compter les substituants de 1 à 3 en regardant le sens de rotation utilisé :
Si dans le sens horaire, la configuration absolue de l’atome est (du latin rectus).
Si se déroule dans le sens anti-horaire, la configuration absolue de l’atome est (du latin sinister).

Exemple :¶
Descripteur stéréochimique (ou quelle est la configuration) du carbone asymétrique de la molécule ci-dessous (et celui de son énantiomère) :
Composé méso : composé achiral appartenant à un ensemble de stéréoisomères possédant des . Il est dépourvu d’activité optique car il possède un élément de symétrie (plan ou centre).
4.6.3 Bilan : À RETENIR IMPÉRATIVEMENT !¶
Si, entre deux stéréoisomères, ... :
... tous les changent de configuration mais pas les (restent ou ) : ils sont images l’un de l’autre, ce sont des énantiomères (sauf s’il y a un élément de symétrie molécule achirale : l’énantiomère est en fait la même molécule (superposable)... c’est le composé méso).
... certains changent de configuration mais pas d’autres OU si des changent de configuration : ils ne sont pas images l’un de l’autre, ce sont des diastéréoisomères.
... aucun et aucune ne change de configuration :
Si l’alignement des substituants change (bien visible en Newman) : stéréoisomères de conformation.
Sinon : molécules identiques (superposables).
L’image dans un miroir plan n’inverse pas la configuration relative () d’un alcène.
Avez-vous tout compris ? - ¶
Compétence : Déterminer la relation d’isomérie entre deux isomères.
4.7 Propriétés comparées des énantiomères et diastéréoisomères¶
4.7.1 Entre deux énantiomères¶
Propriétés physiques de 2 énantiomères : Similaires ( changement d’état, indice de réfraction, spectres IR et RMN, polarité) difficilement séparables. Seule leur activité optique diffère (pouvoirs rotatoires opposés).
Propriétés chimiques (entre énantiomères) :
Identiques vis-à-vis de réactifs/catalyseurs achiraux.
Différentes vis-à-vis de réactifs/catalyseurs chiraux (biologiques).
Absolue nécessité de réussir à séparer des énantiomères ou, mieux, de savoir conduire des synthèses énantiosélectives !
Enjeu MAJEUR en chimie de synthèse nombreux prix Nobel dont celui en 2021 à Benjamin List et David MacMillan pour le développement de l’organocatalyse asymétrique.
4.7.2 Entre deux diastéréoisomères¶
Deux diastéréoisomères n’ont pas les mêmes propriétés physico-chimiques.
4.7.3 Résolution d’un mélange racémique¶
Ou comment séparer des énantiomères ?
Après séparation, on effectue un découplage pour récupérer pur.
5 Relation de stéréoisomérie : bilan¶
Isomères : même formule brute calcul de l’indice d’insaturation (i.i.). La formule semi-développée est-elle la même ?
6 Connaissances et compétences exigibles¶
| Connaissances exigibles | Compétences exigibles |
|---|---|
| Nomenclature systématique | Nommer une molécule ou dessiner sa structure |
| Stéréoisomérie de conformation | Identifier les conformères les plus stables |
| Stéréoisomérie de configuration | Identifier et descripteurs ou |
| Chiralité et Énantiomérie | Identifier une molécule chirale, dessiner un énantiomère |
| Diastéréoisomérie | Identifier les relations entre stéréoisomères |
| Séparation de diastéréoisomères et d’énantiomères. | Déterminer le nombre d’insaturations d’une molécule à partir de sa formule brute ou de sa formule topologique.
Nommer (en nomenclature systématique) une molécule organique monofonctionnelle.
Associer qualitativement la géométrie d’une entité à la minimisation de son énergie.
Comparer la stabilité de plusieurs conformations. Interpréter la stabilité d’un conformère donné.
Passer d’une représentation de Newman à Cram, et inversement.
Attribuer les descripteurs stéréochimiques aux centres stéréogènes.
Déterminer la relation d’isomérie entre deux isomères.
Représenter une entité chimique organique à partir de son nom, fourni en nomenclature systématique, en tenant compte de la donnée d’éventuelles informations stéréochimiques, en utilisant un type de représentation donné.
Relier la valeur du pouvoir rotatoire à la composition d’un mélange de stéréoisomères.
Déterminer la composition d’un système chimique ou suivre une transformation chimique en utilisant l’activité optique. |