Architecture des molécules
Deux atomes A et B peuvent être liés par :
des liaisons simples (indice de liaison )
des liaisons multiples (indice de liaison ou 3)
Doublets non-liants (dnl) (nécessaires pour l’écriture de Lewis)
Les électrons de valence qui ne participent pas aux liaisons covalentes sont aussi regroupés par deux et sont représentés par un trait (ou 2 points), au-dessus ou à côté de l’atome :
Exemples schémas de Lewis (formule développée : sans les dnl) :
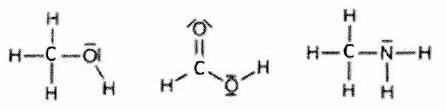

1.2.2 Schéma de Lewis d’un édifice¶
Doublets liants (dl)
Pour vérifier si un atome est à l’octet (ou au duet) :¶
Bien compter TOUS les électrons qui l’entourent : l’intégralité de ses doublets liants et ses doublets non liants.
1.3 Charge formelle et charge réelle¶
1.3.1 Charge formelle : portée par un atome¶
Charge formelle portée par un atome : Différence entre le nombre d’électrons de valence et le nombre d’électrons dans l’environnement immédiat de l’élément dans la molécule dénombrés après partage équitable des liaisons.
Pour déterminer les charges formelles :¶

Avez-vous tout compris ? - ¶
A ne pas confondre avec la charge partielle (cf. paragraphe 4.1) :
Excédent de charge positive ou négative présent sur l’atome en tenant compte de la différence d’électronégativité entre les atomes de la liaison A-B.
Notée et .
À l’origine de la polarité d’une liaison. Charge partielle : si
1.3.2 Charge réelle d’un édifice¶
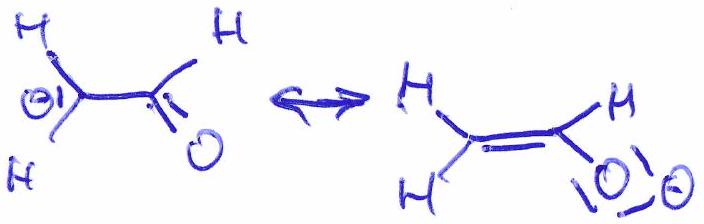
Chacune de ces représentations est appelée « forme mésomère » (« formule mésomère » ou « structure limite de résonance »).
Convention d’écriture : [ forme mésomère forme mésomère ... ]

Ne pas confondre les symboles de flèche « » (mésomérie) avec « » (équilibre physico-chimique).
Mésomérie : passage d’une structure limite de résonance à une autre par des mouvements de doublets d’électrons (appelés électrons ) de proche en proche, symbolisés à l’aide de flèches courbes.
Les formes mésomères sont des représentations d’une même et unique espèce chimique :
Le squelette est inchangé
La charge réelle de chaque forme mésomère doit être la même
Aucune des formules limites n’a d’existence physique : elles doivent être considérées en même temps pour décrire la structure réelle qui est une sorte de moyenne pondérée entre les deux.
La structure réelle est une superposition des différentes formes mésomères : c’est l’hybride de résonance. Elle est assimilable en approximation à une moyenne pondérée des formes mésomères.
Avez-vous tout compris ? - ¶
2.3 Formes mésomères les plus représentatives¶
Toutes les formes mésomères n’ont pas toutes le même poids dans la structure hybride de résonance.
Comment déterminer la (les) structure(s) limite(s) de résonance les plus contributives :¶
Appliquer les 4 règles suivantes par ordre de priorité :
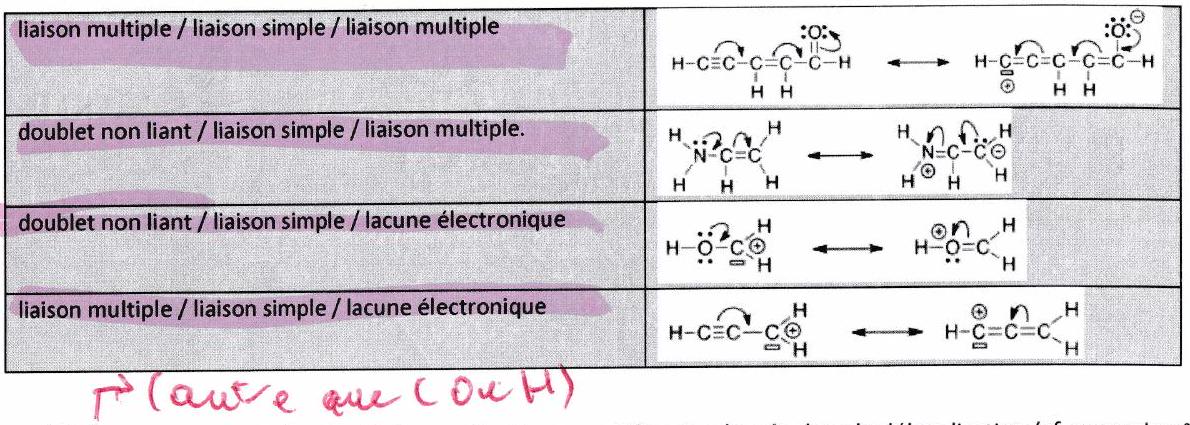
Une forme mésomère sera plus représentative si elle respecte la règle de l’octet pour un maximum d’atomes.
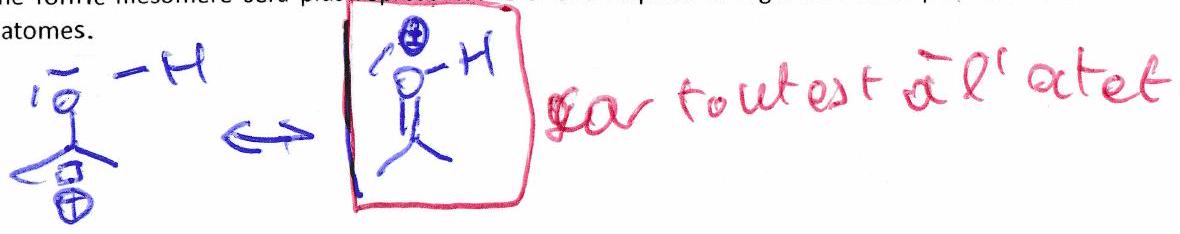
Une forme mésomère sera plus représentative si le nombre de charges formelles est minimisé.
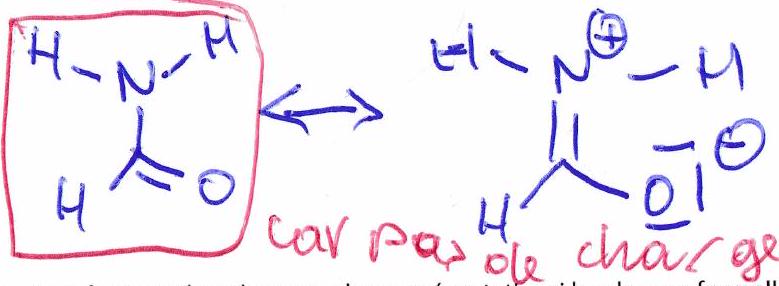
Une forme mésomère sera plus représentative si les charges formelles sont éloignées.
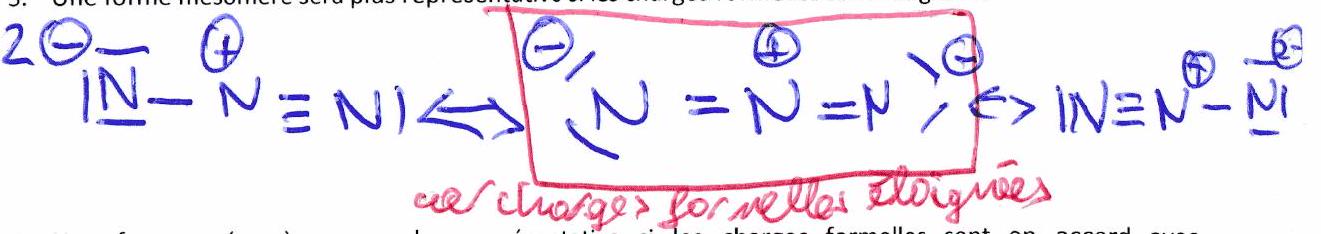
Une forme mésomère sera plus représentative si les charges formelles sont en accord avec l’électronégativité des atomes qui les portent.
2.4 Conjugaison¶
Une entité chimique est conjuguée si la délocalisation implique plus de 2 atomes.
Identifier les enchaînements typiques donnant lieu à une délocalisation électronique :¶
Les hétéroatomes ayant des doublets non-liants peuvent être impliqués dans la délocalisation (cf. exemple ).
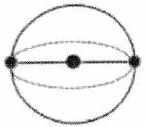
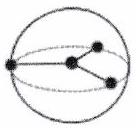
| Directions de répulsion | 2 | 3 | 4 | 5* | 6* |
|---|---|---|---|---|---|
| Répartition sur la sphère |
|
|
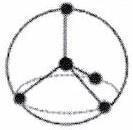
|
|
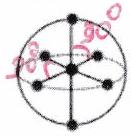
| | Forme | Linéaire | Triangle plan | Tétraèdre régulier | Bipyramide trigonale | Octaèdre régulier |
*Hors programme
En déduire la géométrie en « masquant les directions » correspondant aux doublets non-liants dnl :
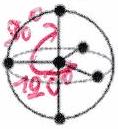
| (Figure de répulsion) | (pas de dnl) | ||
|---|---|---|---|
| linéaire | linéaire |

| |
| triangle plan | triangle plan | coudée |

| | tétraèdre | tétraèdre | pyramidale trigonale | coudée
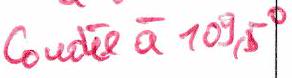
|
Quand : figure de répulsion = géométrie VSEPR
Les angles donnés sont les angles théoriques. Mais on va voir ensuite qu’il y a des facteurs affectant leur valeur, ce qui justifie un écart par rapport à ce qu’on observe expérimentalement .
Avez-vous tout compris ? - ¶
Cas d’une molécule présentant des formes mésomères
Exemple : Quelle est la géométrie de l’ion nitrate ?¶
La géométrie autour de N est intermédiaire entre triangle plan et pyramide trigonale mais plus proche de la pyramide (car c’est la géométrie de la forme la plus représentative).
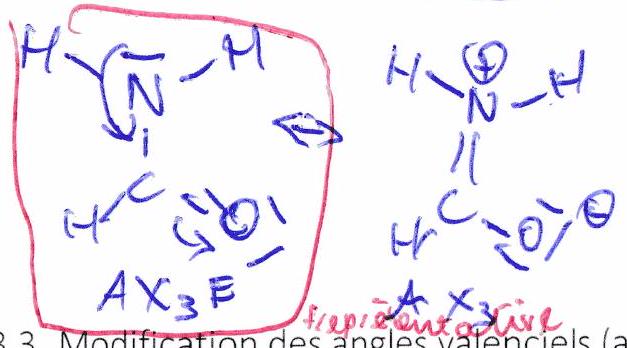
3.3 Modification des angles valenciels (angles )¶
Il y a souvent un écart entre l’angle observé expérimentalement et l’angle théorique prévu par la VSEPR simple.
3.3.1 Effet des doublets non-liants (dnl)¶
| Espèce chimique | ||
|---|---|---|
| () | ||
| () | ||
| () |
Figure de répulsion : tétraèdre ()
: 0 doublet non-liant
: 1 doublet non-liant
: 2 doublets non-liants
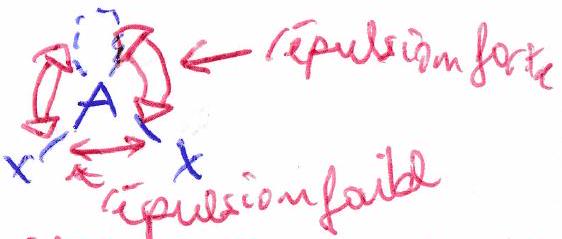
La répulsion d’un dnl est supérieure à celle d’un doublet liant. l’angle est plus fermé qu’attendu : .